Open Journal of Nature Science
Vol.03 No.04(2015), Article ID:16347,10 pages
10.12677/OJNS.2015.34017
Comparison of dsRNA Adjuvants—PIC, PICLC, PIC12U and PICKCa®
Haixiang Lin*, Lietao Li, Yi Zhang
Beijing Yishengxingye Scinece and Technology Co. Ltd., Beijing
*通讯作者。
Received: Oct. 27th, 2015; accepted: Nov. 10th, 2015; published: Nov. 16th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
dsRNA adjuvants include PIC, PICLC, PIC12U (Trade name Ampligen) and PICKCa® (PIC-kanamycin- Cacl2). They are ligands of varied pattern recognition receptors TLR3, NOD, MAD-5 and RID-1. The melt points are 57˚C for PIC, 80˚C for PICKCa, 91˚C for PICLC respectively. Because of the degradation of double stranded RNA in the serum of primates and above, The first two kinds of adjuvants have poor effects or severe side effect to the monkey and human. PIC12U was also denied by US FDA in 2012, while PICKCa overcomes shortcomings of PIC, PICLC and PIC12U and it is safe and effective for monkey and human.
Keywords:dsRNA, Vaccine Adjuvant, PICKCa

双链RNA(dsRNA)佐剂的比较——PIC、PICLC、PIC12U、PICKCa®
林海祥*,李烈涛,张译
北京依生兴业科技有限公司,北京

收稿日期:2015年10月27日;录用日期:2015年11月10日;发布日期:2015年11月16日

摘 要
双链RNA佐剂包括PIC、PICLC、PIC12U和皮卡(PICKCa®),是多种膜式识别受体(TLR3、NOD、MAD-5和RID-1)的配体,熔点分别是PIC 57℃,PICKCa 80℃,PICLC 91℃。由于灵长目以上动物血清核酸酶对双链RNA的降解,前两种佐剂对猴和人体或者效果差或者副作用大,且美国FDA在2012年也把PIC12U否决了,而我们研制的皮卡佐剂(PICKCa®)弥补了其它dsRNA佐剂的不足,对灵长类动物和人安全有效。
关键词 :双链RNA,疫苗佐剂,皮卡

1. 引言
双链RNA佐剂是多种膜式受体(PRRs)的配体,通过改变免疫类型,有可能使预防性疫苗成为治疗性疫苗,这种改变是具有重大的理论和现实意义的。目前包括PIC (polyriboinosinic-polyribocytoidylic acid)、PICLC (PIC with poly-L-lysine and carboxymethylcellulose)、PIC12U (PIC with uridylic acid in specific interval,商品名Ampligen)、PICKCa (PIC-kanamycin-Cacl2,皮卡®)几种。国际上对前三种比较熟悉,对后一种皮卡®由于是我国独有的人用抗病毒针剂,我们又已在35个国家获得专利,国内外同行很少接触而相对陌生。由于灵长目以上动物血清核酸酶的水解作用,使PIC人体应用效果很差;PICLC人体应用有效但副作用大;PIC12U经过大量研究和临床试验还是在2012年被美国FDA否决了。因此国际上熟悉的dsRNA佐剂一方面或是很有效的,一方面又或是安全性很差的。我们多年的工作恰恰证实我们发现的另一种双链RNA佐剂——皮卡®弥补了前三种dsRNA的不足,人用安全有效。这就大大拓展了开发和应用dsRNA佐剂抗细胞内感染、抗肿瘤治疗性疫苗的可行性。我们愿意以皮卡佐剂与国内外同行合作开发皮卡治疗性疫苗以解决可恶的肿瘤转移和细胞内感染难题,包括近年和近期流行的SARS、MERS等。本文将综述dsRNA类似物皮卡佐剂与其它dsRNA佐剂的异同,特别是皮卡佐剂对猴和人体的安全性、有效性,还有与美国全球结核病研究所(AERAS)协作研究皮卡结核菌重组抗原促进细胞免疫的初步效果,以此献给全世界的同行们。
2. PIC、PICLC、PIC12U研究概况
PIC是上世纪60年代由美国默克公司研制的。在小白鼠中,PIC是IFN-α诱生剂,有抗病毒活性[1] [2] 。MDA-5 (黑色瘤分化相关基因5,是胞浆内核酸受体,识别ds RNA,激活NF-κB,促进IFN1产生。)对PIC诱生IFN反应是重要的[3] [4] 。在流感病毒试验中,通过对小白鼠鼻腔滴入PIC血凝素(HA)抗原能诱发强烈的IgA和血清IgG,而没有PIC的HA抗原几乎没有反应,PIC可以保护小白鼠鼻腔和肺部致死性的感染[5] 。PIC还是粘膜佐剂可诱生体液和细胞免疫[5] -[7] 。PIC还能提高小白鼠体内针对肿瘤的特异性T细胞免疫[8] [9] 。然而由于灵长类动物和人血清核酸酶对PIC的降解,减低PIC结构的稳定性,只产生很少IFN-α [10] ,也不具有抗肿瘤活性[10] [11] 。高剂量PIC在I、II期肿瘤患者临床研究中发生了严重副反应,包括休克、肾衰竭和凝血病[12] 。
PICLC是Levy HB等上世纪70年代研制的,即PIC与聚赖氨酸(PolyL-lysine,相对分子质量27,000)和羧甲基纤维素(CMC,相对分子质量700,000)的结合物,使相对分子质量增大了许多,较PIC能5~10倍抵抗灵长目动物核酸酶水解,并在猴体内产生显著的干扰素[13] 。在小白鼠中枢神经系统肿瘤与使用单纯疫苗比较中,促进产生2~4倍CTL反应,提高2倍存活率[14] 。在恒河猴感染人乳头瘤病毒(HPV)研究中,PICLC-HPV疫苗与单纯HPV疫苗相比增加分泌IFN-r细胞2倍,对HPV特异的CD4+ T细胞反应提高5倍,在加强免疫中,提高酶标免疫法检测HPV抗体滴度1000倍[15] 。PICLC在猴体和猩猩内具有抗不同病毒活性[16] [17] ,在恒河猴体内具有抑制疟疾感染作用[18] 。对马脑脊髓炎和猪流感病毒抗原有促进体液免疫的佐剂作用[19] [20] 。PICLC初步的临床研究表明治疗剂量引起中到重度反应,发烧(100%),肌痛(50%),低血压(50%),白细胞明显下降等[21] 。
PIC12U是上世纪70年代中期在美国约翰霍普金斯大学研制的,是在PIC链一定位置插入尿嘧啶核苷酸,被广泛用于研究。效力类似PIC,但毒性较少[22] 。PIC12U在小白鼠中能引起广泛的抗病毒反应[23] [24] ,在人体内有低毒性反应[25] ,在临床前研究中,PIC12U可以使人DC细胞成熟,分泌IL-12 [26] ,活化的DC促进抗原特异的CTL反应,使分化的CD4 T细胞趋向Th1反应[27] 。在H5N1流感病毒感染模型中,疫苗与PIC12U复合后鼻内免疫,可提供3倍IgA抗体,显著降低死亡率。PIC12U对癌症患者I-II期临床研究表明有较好的的耐受性[28] ,这反映了与PICLC比较加速了核酸酶对双链RNA的水解和更短的半衰期[28] [29] 。单独作为抗感染治疗和用于HIV和抗疲劳综合征进入了II-III期临床研究。2012年8月Hemispherx生物药品公司呈送了进一步原始的临床研究资料,但还是以安全性和有效性资料不足被美国食品药品管理局(FDA)否决了[30] 。
3. 皮卡® (PICKCa)佐剂及其疫苗在猴和人体有效性和安全性的研究
皮卡(PIC-Kanamycin-Cacl2)是双链聚肌苷酸聚胞苷酸及微量卡那霉素和氯化钙的复合物。PIC是大分子的聚阴离子,卡那霉素是多胺基化合物,带正电荷,与PIC聚阴离子结合,稳定了PIC的双链结构,可以在一定程度上抵抗核酸酶的降解。在PIC中加入氯化钙可增加对细胞的通透性和细胞的结合力,增加诱生出的干扰素产量[31] 。1979年,第二次国际干扰素会议期间,美国H. Lery博士将我国的PICKCa与他们制备的PIC和PICLC进行了熔点对照测定,结果PIC为57℃,PICKCa为80℃,PICLC为91℃。说明国产加入卡那霉素和氯化钙的PICKCa形成了较PIC相对分子质量更大的结合物,保护PIC双链结构不被灵长类以上动物核酸酶快速水解,从而有较好的稳定性,使其能够发挥应有的作用[31] 。
把皮卡作为佐剂以来,我们已在国内外发表若干篇皮卡佐剂疫苗的研究报告,包括狂犬病疫苗[32] - [35] 、乙肝疫苗[36] 、流感疫苗[37] -[39] 、SARS抗原[40] 等,其中大部分是小白鼠,个别是狗的试验结果。在法国巴斯德研究所我们比较了皮卡佐剂和铝佐剂在狂犬病疫苗中的效果,结果是铝佐剂疫苗与单纯疫苗比较虽然最终提高了抗体滴度,但延迟了抗体产生,对暴露后小白鼠致死性的感染完全没有保护作用,而皮卡佐剂狂犬病疫苗与铝佐剂疫苗、单纯疫苗比较产生的保护性抗体早、高、时间长;对暴露后小白鼠95%的致死性的感染几乎完全可以保护。因此,我们建议在当时中国含铝佐剂狂犬病疫苗中去掉铝佐剂[41] ,后来实现了。由于灵长类动物血清核酸酶减低dsRNA结构的稳定性,因此研制人用疫苗而评价dsRNA佐剂的有效性和安全性应该在灵长类动物甚至人体中进行。以下为皮卡佐剂及其疫苗在猴和人体中的安全性和有效性及其特点。
3.1. 皮卡佐剂是我国独有的人用抗病毒针剂药品
皮卡(PICKCa)原是抗病毒药物,商品名为聚肌胞注射液,是我国独有的具有国家标准的人用注射药品[42] 。国产聚肌胞注射液是无色澄清透明的液体,经过3年的观察测定,其含量、相对分子质量、增色效应和pH值均较稳定[31] 。聚肌胞注射液用于治疗病毒性角膜炎、单纯疱疹、流行性腮腺炎、预防呼吸道感染,也用于肝炎的辅助治疗。聚肌胞注射液国家标准,临床用量为每次1~2 mg,隔日1次,肌肉注射。临床上不同病种注射针次不完全一致,如治疗慢性乙肝病人以0.02~0.04 mg/kg体重,每周2次肌注或静脉注射,疗程3~6个月为宜。天津市聚肌胞注射液标准采用每次2或4 ml (含2或4 mg)/针,隔日1次,肌肉注射。国产聚肌胞注射液药物代谢动力学表明,肌注小白鼠3H- PICKCa注射液0.1 ml/只,血液中5分钟即可检测到放射性,持续较高水平达48小时,至144小时降至<5%;脏器中30分钟放射性达到高峰,可见从血液进入组织的速度相当快,2~5小时逐渐下降,26小时下降至高峰值的60%,至144小时降至<17%,各脏器以肾、脾、肝最高,其次为肺、心、肌肉、脑;给药1小时后尿中即可检测到放射性,8小时排出26%,100小时排出注射量的44.5%。通过粪便排出量很少,100小时排出注射量的2.44%。说明肌注3H- PICKCa注射液吸收很快,5分钟即可检测到放射性,10小时达到高峰,144小时后基本排出,能很好地透过血脑屏障,排泄途径以肾脏为主。作为一种药物,在体内保持一定时间后能被降解排泄掉,因此有较好的安全性[31] 。另一方面,试验也表明,只要聚肌胞在人体内完整地存在1小时,作用于细胞膜上的受体就能使细胞发生一系列变化,产生出抗病毒蛋白来[43] ,这些特点使PICKCa有效、安全,不会像PICLC一样致出现毒性。
1981年,经国家批准PICKCa用于临床,很多厂家投入生产,如天津、北京、杭州、广州等,产量至少每年几千万支。仅浙江万马药业有限公司自1984年开始销售聚肌胞注射液,临床使用未发现严重的不良反应。该公司1999年销售1432.02万支,2000年销售1764.47万支,2001年销售1320.88万支。
3.2. 皮卡狂犬病疫苗在恒河猴体内的安全性和有效性(李烈涛,张译,林海祥等申请临床研究资料)
人用皮卡狂犬病疫苗里含有PICKCa 1 mg/ml/针,暴露后0、3、7、14、28天各注射1针。用磷测定法测定皮卡含量,用琼脂糖电泳法检测皮卡分子量,保证了作为疫苗佐剂皮卡生物功能及毒副作用的可控性。疫苗中皮卡的限量为1 mg,以标示量的100%~130%为合格。人用皮卡狂犬病疫苗的合格检测须通过国家聚肌胞注射液检测标准[42] 和国家人用狂犬病疫苗检测标准[44] 以及企业标准(林海祥,郭可謇,刘芳等申请临床研究资料)。
皮卡狂犬病疫苗在恒河猴的检定由国家药物安全监测评价中心进行。32只恒河猴肌肉注射皮卡狂犬病疫苗,高剂量组:2 ml/0天、2 ml/2天、1 ml/7天、1 ml/28天、1 ml/42天;低剂量组:1 ml/0天、1 ml/2天、0.5 ml/7天、0.5 ml/28天、0.5 ml/42天。在相当人体20倍剂量下皮卡佐剂和皮卡狂犬病疫苗安全评价结果为:1) 无免疫毒性,包括临床体征、免疫器官、抗核抗体、T淋巴细胞检测综合评价。2) 对注射局部无刺激作用。3) 对临床症状、心电图、血液、血清生化、尿液、眼睛无明显影响。4) 对各脏器未引起病理变化,包括脑、垂体、甲状腺及甲状旁腺、颌下腺、胸腺、心、肺及支气管、肝、肾、肾上腺、脾、睾丸、附睾、前列腺、卵巢和子宫、骨髓。5) 高、低剂量组血清中产生高达10~15倍保护性中和抗体(0.5 IU/ml)。已在新加坡进行临床研究。
3.3. 皮卡乙肝疫苗在猴体内的安全性和有效性(李烈涛,张译,林海祥等申请临床研究资料)
乙肝疫苗在恒河猴的长期毒性由国家药物安全监测评价中心进行,使用年龄约为2~3岁的、血清乙肝表面抗原和表面抗体均为阴性的40只恒河猴,通过肌肉注射给予皮卡乙型肝炎疫苗,高剂量组:1000 μg皮卡 + 40 μg抗原,低剂量组:500 μg皮卡 + 20 μg抗原;免疫时间:0、14、28、56、84天共5次。结果为:全部实验组动物的给药部位、体重、血压、心电图等指标均未见明显异常。临床症状观察、进食量、血液学检查指标、血清生化检查、尿检查指标均未见和供试品和佐剂相关的显著性改变。抗体检测结果表明,肌肉注射给予恒河猴皮卡乙型肝炎疫苗2周后能明显产生抗乙型肝炎病毒的抗体。脏器的大体病理学和组织病理学检查发现注射疫苗后脾脏的绝对重量和相对重量有增加的趋势,脾脏白髓生发中心的易染体巨噬细胞数量增多,有丝分裂相增多和白髓增生,这些病变具有可恢复趋势。未见其它和供试品相关的异常病变。
结论为:1) 皮卡乙肝疫苗按上述方案首次免疫后21、40天血清ELISA抗体皮卡乙肝疫苗组较无佐剂疫苗组增加50~60倍。2) 皮卡乙肝疫苗在相当人体20倍剂量下反复肌肉注射,猴体的耐受性、安全性良好。已在新加坡进行临床研究。
3.4. 皮卡狂犬病疫苗1期人体临床研究的安全性和有效性(林海祥,迮文远,刘瑜睻等申请临床研究资料)
根据卫生部药政局(96)制申体第19号临床研究批件于1998年5月在内蒙古土默特右旗对人用皮卡狂犬病原制疫苗进行I期人体观察,使用的的疫苗配方是:1) 2 mg/2ml皮卡(PICKCa) 2 ml与2 ml原制苗(未提纯的狂犬病疫苗)复合。2) 2 mg/2ml皮卡(PICKCa) 2 ml稀释法国维尔博狂犬病冻干疫苗。这两种疫苗与国产浓缩狂犬病疫苗进行了比较。主持单位卫生部北京生物制品研究所报告的结论为:
1) 人用皮卡狂犬病疫苗全程(5针)接种人体是安全的。
2) 人用皮卡狂犬病疫苗产生的中和抗体早于国产浓缩狂犬病疫苗,与法国维尔博疫苗近似。
3) 人用皮卡狂犬病疫苗和皮卡维尔博狂犬病疫苗刺激机体产生的干扰素显著高于国产狂犬病疫苗和法国维尔博狂犬病疫苗;人用皮卡狂犬病疫苗产生的干扰素还高于皮卡维尔博疫苗产生的干扰素。
4) 人用皮卡狂犬病疫苗不经浓缩对人体可产生较好的免疫反应,有实际应用前景。
5) 皮卡对人体有较好的免疫增强作用,是一有前途的人用佐剂。
综上所述,皮卡新佐剂与狂犬病原制苗或纯化苗复合后在I期人体观察中安全有效,不仅促进了体液免疫也促进了细胞免疫,显示了很好的佐剂作用。
需要说明的皮卡疫苗研究30年不是技术原因造成的拖延,相反是时时有好结果鼓励我们前行。如这次临床研究当时用的是未经纯化的狂犬病原制苗加皮卡制成,后改为纯化苗废弃原制苗故未批准继续临床研究,整整十年后即2006年5月皮卡狂犬病疫苗再次被国家药监局批准临床研究,然而这一次原申报单位已无力支撑继续研究破产了,而转入新单位被要求重新申报,又几乎过了十年现在我们又开始了新的申请征程。
3.5. 皮卡佐剂狂犬病疫苗促进人体免疫记忆细胞产生IFN-γ (林海祥,李烈涛,郭可謇等内部材料)
对2名志愿者全程5针免疫皮卡狂犬病疫苗2.5年后,取外周血单个核细胞,用狂犬病抗原体外刺激,以ELISPOT方法检测,下图1结果可见到志愿者外周血单个核细胞IFN-γ与未注射狂犬病疫苗正常人比较经相应抗原刺激后IFN-γ显著增加。
由于II型IFN-γ是由NK细胞和激活的T淋巴细胞产生,NK细胞产生的IFN-γ是在免疫早期,而且是非特异的,免疫2.5年产生的IFN-γ只能是由激活的T免疫记忆淋巴细胞产生,而且是特异性的,表明皮卡狂犬病疫苗对人体有很好的细胞免疫记忆反应,这是皮卡佐剂疫苗对人体十分重要的免疫特性。
3.6. 皮卡狂犬病疫苗作为未批准特殊商品疫苗的非法应用
国家药监局2月例行新闻发布会新闻发言人通报该公司违法添加核酸物质。中国药品生物制品检定所在回答记者问题所讲添加的核酸物质内容即是PICKCa佐剂。某公司是在美国上市公司,是主要生产狂犬病疫苗的企业。经国家不良反应中心监测该疫苗用于人体后无失败病例又无不良反应发生。

Figure 1. No. of IFN-γ SPF in PBMCs of volunteers immunized with rabies vaccine using PICKCa adjuvant
图1. 皮卡佐剂狂犬病疫苗促进人体免疫记忆细胞产生IFN-γ SPF数量
一个不争的事实是,被动物咬伤后接种了狂犬病疫苗仍然会发生狂犬病死亡,多在接种疫苗的过程中,甚至在疫苗全程注射后发病死亡[45] 。有不少报告,这种免疫失败率为10%~20% [46] [47] 。广西疾病预防控制中心报道,2003至2004年广西共报告狂犬病发病死亡病例1120例,对其中725例分析,有197例为被疯动物或疑似疯动物咬伤后注射狂犬病疫苗的,占725例发病死亡病例的27.2%,大多数(72.1%)在接种第4针、第5针疫苗后发病死亡[48] 。
这种特殊情况下大规模的现场应用至少是皮卡狂犬病疫苗人体应用安全有效的佐证而不应该被完全忽视。
4. 与美国全球结核病研究所(AERAS)合作对皮卡结核菌重组蛋白疫苗的研究(李烈涛,张译,林海祥等内部材料)
美国全球结核病研究所(Aeras Gaithersburg, Maryland, USA)作为世界最大的非营利性生物技术机构之一,一直处于现代结核疫苗研发的技术前沿。在过去的十年中,进入临床试验阶段的结核疫苗从零增加到十二种,其中六种是由Aeras开发的或由Aeras及其合作伙伴支持开发的。将Aeras近年来开发出BARv结核菌重组蛋白分别加入皮卡佐剂、TLR9配体CPG佐剂并与阴性对照比较,如图2显示阴性对照、BCG、重组蛋白和BARv加CPG9佐剂初次免疫的小鼠只有大约1%的CD4+ T细胞可以产生干扰素(IFN-γ)。而皮卡佐剂BARv接受再次次免疫可以检测到3.5%~4.5% CD4+ T细胞可以产生干扰素。与TLR9佐剂相比,无论是BCG还是重组蛋白免疫的小鼠,皮卡®都能使产生干扰素的CD4+ T细胞增加近1倍,另外两个与抗结核相关的细胞因子,白介素-2 (IL-2)和肿瘤坏死因子-α (TNF-α),皮卡®也能使产生相应细胞因子的CD4 T细胞数分别增加31%和82%。
图3显示将相同数量的外周淋巴细胞在体外与不同的结核抗原蛋白组分进行刺激培养,以皮卡®作为佐剂进行增强免疫的小鼠的外周淋巴细胞,其产生干扰素的能力比TLR3 CPG组均高出一倍以上。
上述研究尽管是在小白鼠进行的,但结果表明皮卡®在新型结核疫苗或其它疫苗产品中有良好的实际应用前景,AERAS拟将在猴体内进一步研究。
5. 皮卡佐剂特点
1) 由于皮卡显著的佐剂效果,减少了抗原用量,降低了杂质,提高了疫苗质量,在小白鼠、狗、猴和人体的研究和应用中都证明是安全的。
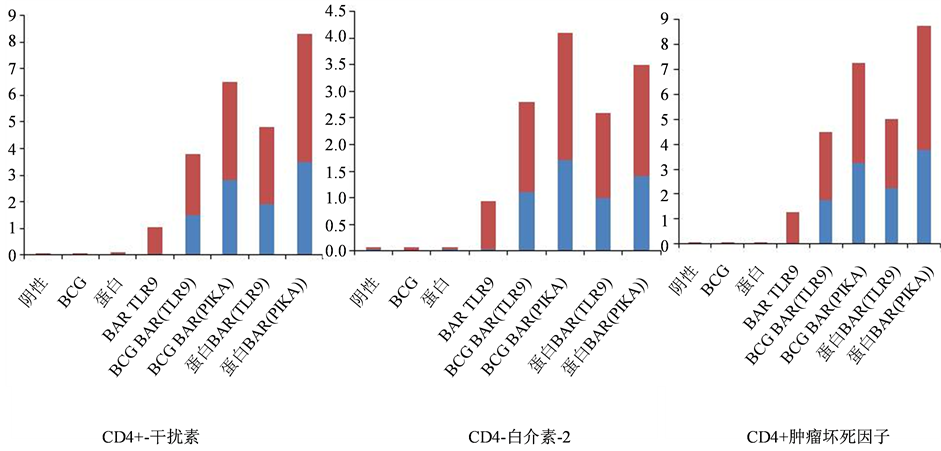
Figure 2. The ratio of T to CD4+ T cells of the corresponding cytokines which were produced with different enhanced immune cells detected by flow cytometry
图2. 流式细胞仪检测不同的增强免疫产生相应细胞因子的CD4+ T细胞的比率

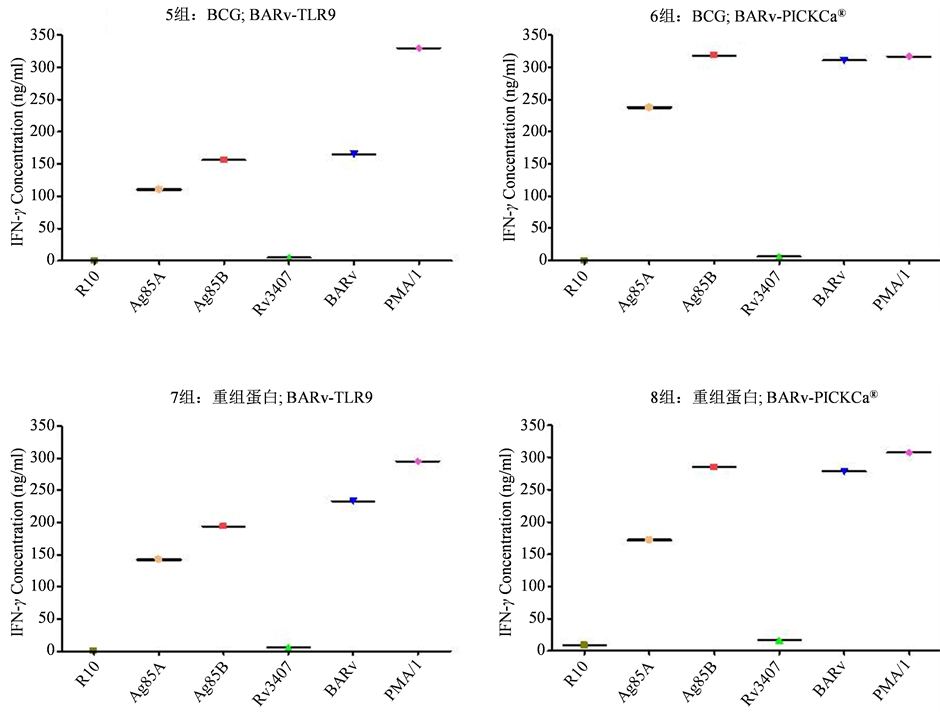
Figure 3. Comparison produced IFN-γ concentration in PBMC (peripheral blood monoclear) stimulated by PICKCa or TLR-9 adjuvants with different BCG antigenss
图3. 皮卡和TLR-9佐剂与不同结核菌抗原刺激外周血单个核细胞产生IFN-γ的比较
2) 皮卡佐剂促进机体的非特异性免疫和特异性免疫,包括细胞免疫、体液免疫、粘膜免疫。这些结果不仅在小白鼠和狗中,在猴和人体中也具有相似结果。更由于趋向细胞免疫而使皮卡疫苗具有治疗作用,这一特性具有十分重要的理论和现实意义。
3) 皮卡佐剂疫苗可通过肌肉、皮下和粘膜途径免疫,均可引起显著的非特异和特异性免疫反应。
4) 皮卡佐剂疫苗冻干和水溶液制剂均能稳定保存。
5) 已建立工业化符合GMP质量的生产设施,能够稳定生产,降低成本。
由于皮卡佐剂及其疫苗显著的特别是猴和人体的效果和安全性,使我们坚持研究30年了,在我们心中期待着皮卡佐剂及其疫苗导致具有深远意义的21世纪治疗革命的到来。我们一家民营公司很难承担这样巨大的任务,我们愿意开展全球范围的协作,与同行包括政治家、管理者共同践行这个过程。
文章引用
林海祥,李烈涛,张 译. 双链RNA(dsRNA)佐剂的比较——PIC、PICLC、PIC12U、PICKCa®
Comparison of dsRNA Adjuvants—PIC, PICLC, PIC12U and PICKCa®[J]. 自然科学, 2015,
03(04): 127-136. http://dx.doi.org/10.12677/OJNS.2015.34017
参考文献 (References)
- 1. Richmond, J.Y., Hamilton, L.D. (1969) Foot-and-Mouth Disease Virus Inhibition Induced in Mice by Synthetic Double-Stranded RNA (Polyriboinosinic and Polyribocytidylic Acids). Proceedings of the National Academy of Sciences of the United States of America, 64, 81-86. http://dx.doi.org/10.1073/pnas.64.1.81
- 2. Thomson, A.W. (1977) The Influence of Poly I: Poly C on Kinetics of the Primary Immune Response to Sheep Erythrocytes in the Mouse Spleen. Biomedicine, 26, 319-326.
- 3. Gitlin, L., Barchet, W., Gilfillan, S., Cella, M., Beutler, B., Flavell, R.A., et al. (2006) Essential Role of MDA-5 in Type I IFN Responses to Polyriboinosinic: Polyribocytidylic Acid and Encephalomyocarditis Picornavirus. Proceedings of the National Academy of Sciences of the United States of America, 103, 8459-8464. http://dx.doi.org/10.1073/pnas.0603082103
- 4. Kato, H., Takeuchi, O., Sato, S., Yoneyama, M., Yamamoto, M., et al. (2006) Differential Roles of MDA5 and RIG-I Helicases in the Recognition of RNA Viruses. Nature, 441, 101-105. http://dx.doi.org/10.1038/nature04734
- 5. Ichinohe, T., Watanabe, I., Ito, S., Fujii, H., Moriyama, M., Tamura, S., et al. (2005) Synthetic Double-Stranded RNA Poly(I:C) Combined with Mucosal Vaccine Protects against Influenza Virus Infection. Journal of Virology, 79, 2910- 2919.
- 6. Partidos, C.D., Hoebeke, J., Moreau, E., Chaloin, O., Tunis, M., Belliard, G., et al. (2005) The Binding Affinity of Double-Stranded RNA Motifs to HIV-1 Tat Protein Affects Transactivation and the Neutralizing Capacity of Anti-Tat Antibodies Elicited after Intranasal Immunization. European Journal of Immunology, 35, 1521-1529.
- 7. Sloat, B.R. and Cui, Z.R. (2006) Nasal Immunization with a Dual Antigen Anthrax Vaccine Induced Strong Mucosal and Systemic Immune Responses against Toxins and Bacilli. Vaccine, 24, 6405-6413. http://dx.doi.org/10.1016/j.vaccine.2006.06.002
- 8. Pulko, V., Liu, X., Krco, C.J., Harris, K.J., Frigola, X., Kwon, E.D. and Dong, H.D. (2009) TLR3-Stimulated Dendritic Cells Up-Regulate B7-H1 Expression and Influence the Magnitude of CD8 T Cell Responses to Tumor Vaccination. The Journal of Immunology, 183, 3634-3641. http://dx.doi.org/10.4049/jimmunol.0900974
- 9. Carrie, A.J., van der Most, R.G., Broomfield, S.A., Prosser, A.C., Tovey, M.G. andRobinson, B.W.S. (2008) Targeting the Effector Site with IFN-αβ-Inducing TLR Ligands Reactivates Tumor-Resident CD8 T Cell Responses to Eradicate Established Solid Tumors. The Journal of Immunology, 180, 1535-1544. http://dx.doi.org/10.4049/jimmunol.180.3.1535
- 10. Nordlund, J.J., Wolff, S.M. and Levy, H.B. (1970) Inhibition of Biologic Activity of Poly I: Poly C by Human Plasma. Proceedings of the Society for Experimental Biology and Medicine, 133, 439-444. http://dx.doi.org/10.3181/00379727-133-34492
- 11. McFarling, D.E., Bever, C.T., Salazar, A.M., et al. (1985) A Preliminary Trial of Poly(IC)-LC in Multiple Sclerosis. Journal of Biological Response Modifiers, 4, 544-548.
- 12. Robinson, R.A., De Vita, V.T., Levy, H.B., et al. (1976) A Phase I-II Trial of Multiple-Dose Poliriboinosic Acid-Po- lyribocytidylic Acid in Patients with Leukemia or Solid Tumors. Journal of the National Cancer Institute, 57, 599- 602.
- 13. Levy, H.B., Baer, G., Baron, S., Buckler, C.E., Gibbs, C.J., et al. (1975) A Modified Polyriboinosinic-Polyribocyti- dylic Acid Complex that Induces Interferon Inprimates. Journal of Infectious Diseases, 132, 434-439.
- 14. Sammons, M.L., Stephen, E.L., Levy, H.B., Baron, S. and Hilmas, D.E. (1977) Interferon induction in cynomolgus and rhesus monkey after repeated doses of a modified polyriboinosinic-polyribocytidylic acid complex. Antimicrobial Agents and Chemotherapy, 11, 80-83. http://dx.doi.org/10.1128/AAC.11.1.80
- 15. Sahl-Hennig, C., Eisenblatter, M., Jasny, E., et al. (2009) Synthetic Double-Stranded RNAs Are Adjuvant for the Induction of T Helper 1 and Humoral Immune Responses to Human Papillomavirus in Rhesus Macaques. PLoS Pathogens, 5, e1000373. http://dx.doi.org/10.1371/journal.ppat.1000373
- 16. Levy, H.B., London, W., Fuccillo, D.A., Baron, S. and Rice, J. (1976) Prophylactic Control of Simian Hemorrhagic Fever in Monkeys by an Interferon Inducer, Polyriboinosinic-Polyribocytidylic Acid-Poly-L-Lysine. Journal of Infectious Diseases, 133, A256-A259. http://dx.doi.org/10.1093/infdis/133.Supplement_2.A256
- 17. Stephen, E.L., Sammons, M.L., Pannier, W.L., Baron, S., Spertzel, R.O., et al. (1977) Effect of a Nuclease-Resistant Derivative of Polyriboinosinic-Polyribocytidylic Acid Complex on Yellow Fever in Rhesus Monkeys (Macaca mulatta). Journal of Infectious Diseases, 136, 122-126.
- 18. Puri, S.K., Dutta, G.P., Levy, H.B. and Maheshwari, R.K. (1996) Poly ICLC Inhibits Plasmodium cynomolgi B Malaria Infection in Rhesus Monkeys. Journal of Interferon & Cytokine Research, 16, 49-52. http://dx.doi.org/10.1089/jir.1996.16.49
- 19. Houston, W.E., Crabbs, C.L., Stephen, E.L. and Levy, H.B. (1976) Modified Polyriboinosinic-Polyribocytidylic Acid, an Immunological Adjuvant. Infection and Immunity, 14, 318-319.
- 20. Stephen, E.L., Hilmas, D.E., Mangiafico, J.A. and Levy, H.B. (1977) Swine Influenza Virus Vaccine: Potentiation of Antibody Responses in Rhesus Monkeys. Science, 197, 1289-1290.
- 21. 侯云德, 吴淑华, 编. 干扰素[M]. 北京: 人民卫生出版社, 1981: 108-111.
- 22. Carter, W.A., Pitha, P.M., Marsall, L.W., et al. (1972) Structural Requirements of the rln•rCn Complex for Induction of Human Interferon. Journal of Molecular Biology, 70, 567-587. http://dx.doi.org/10.1016/0022-2836(72)90560-8
- 23. Ichinohe, T., Tamura, S., Kawaguchi, A., Ninomiya, A., Imai, M., et al. (2007) Cross Protection against H5N1 Influenza Virus Infection Is Afforded by Intranasal Inoculation with Seasonal Trivalent Inactivated Influenza Vaccine. Journal of Infectious Diseases, 196, 1313-1320.
- 24. Ichinohe, T., Kawaguchi, A., Tamura, S., Takahashi, H., Sawa, H., et al. (2007) Intranasal Immunization with H5N1 Vaccine plus Poly I: Poly C12U, a Toll-Like Receptor Agonist, Protects Mice against Homologous and Heterologous Virus Challenge. Microbes and Infection, 9, 1333-1340.
- 25. Thompson, K.A., Strayer, D.R., Salvato, P.D., Thompson, C.E., Klimas, N., et al. (1996) Results of a Double-Blind Placebo-Controlled Study of the Double-Stranded RNA Drug Poly I: Poly C12U in the Treatment of HIV Infection. European Journal of Clinical Microbiology & Infectious Diseases, 15, 580-587.
- 26. Adans, M., Navabi, H., Jasani, B., et al. (2003) Dendritic Cell (DC) Based Therapy for Cervical Cancer: Use of DC Pulsed with Tumour Lysate and Matured with a Novel Synthetic Clinically Non-Toxic Double Strainded RNA Analogue Poly I: Poly C12U (Ampligen R). Vaccine, 21, 787-790. http://dx.doi.org/10.1016/S0264-410X(02)00599-6
- 27. Navabi, H., Jasani, B., Reece, A., et al. (2009) A Clinical Grade Poly I: C-Analogue (Ampligen) Promotes Optimal DC Maturation and Th1-Type T Cell Responses of Healthy Donors and Cancer Patients in Vitro. Vaccine, 27, 107-115. http://dx.doi.org/10.1016/j.vaccine.2008.10.024
- 28. Brodsky, I., Strayer, D.R., Krueger, L.J., et al. (1985) Clinical Studies with Ampligen (Mismatched Double-Stranded RNA). Journal of Biological Response Modifiers, 4, 669-675.
- 29. Carter, W.A., Strayer, D.R., Hubbell, H.R., et al. (1985) Preclical Studies with Ampligen (Mismatched Double- Stranded RNA). Journal of Biological Response Modifiers, 4, 495-502.
- 30. US FDA Response Letter Regarding Approval of Ampligen for ME/CFS, 2012.
- 31. 宗建超. 聚肌胞(PIC)研究回顾[C]// 中国微生物学会. 全国第五次干扰素学术会议论文集. 西安, 1985: 23-28.
- 32. Lin, H.X., Gontier, C., Saron, M.-F., et al. (1993) A New Immunostimulatory Complex (PICKCa) in Experimental Rabies: Antiviral and Adjuvant Effects. Archives of Virology, 131, 307. http://dx.doi.org/10.1007/BF01378634
- 33. 林海祥, 俞永新. 皮卡佐剂狂犬病疫苗的有效性[J]. 中国生物制品学杂志, 2010(9): 1028-1031.
- 34. 李茂光, 俞永新, 李加, 等. Poly IC佐剂狂犬病疫苗诱导小鼠的免疫应答[J]. 中国生物制品学杂志, 2010(8): 852- 856.
- 35. 林海祥, 俞永新. 皮卡佐剂狂犬病疫苗的安全性[J]. 中国生物制品学杂志, 2010(1): 98-100.
- 36. Shen, E.X. and Wu, C.Y. (2007) PIKA as an Adjuvant Enhances Specific Humoral and Cellular Immune Responses Following the Vaccination of Micee with HBsAg plus PIKA. Cellular & Molecular Immunology, 4, 11.
- 37. Lau, Y.F., Tang, L.-H., Ooi, E.E. and Subbarao, K. (2010) Activation of the Innate Immune System Provides Broad- Spectrum Protection against Influenza A Viruses with Pandemic Potential in Mice. Virology, 406, 80-87. http://dx.doi.org/10.1016/j.virol.2010.07.008
- 38. Lau, Y.-F., Tang, L.-H. and Ooi, E.-E. (2009) A TLR3 Ligand that Exhibits Potent Inhibition of Influenza Virus Replication and Has Strong Adjuvant Activity Has the Potential for Dual Applications in an Influenza Pandemic. Vaccine, 27, 1354-1364. http://dx.doi.org/10.1016/j.vaccine.2008.12.048
- 39. Tang, L.-H., Lim, J.H., Kuah, L.F., et al. (2014) Compete Protection against Lethal Challenge of Novel H7N9 Virus with Heterologous Inactevated H7 Vaccine in Mice. Vaccine, 32, 5375-5378. http://dx.doi.org/10.1016/j.vaccine.2014.07.087
- 40. Gai, W.-W., Zhang, Y., Zhou, D.-H., et al. (2011) PIKA Provides an Adjuvant Effect to Induce Strong and Systemic Humoral Immunity against SARS-CoV. Virologica Sinica, 26, 81-94. http://dx.doi.org/10.1007/s12250-011-3183-z
- 41. 林海祥, Perrin, P. 铝佐剂对实验狂犬病疫苗的影响[J]. 中华实验和临床病毒学杂志, 1999(2): 133-135.
- 42. 聚肌胞注射液国家药品标准. WS1-XG-050-2000.
- 43. 杜平, 叶天星. 现代抗病毒制剂的临床应用[M]. 上海: 上海科学技术出版社, 1992: 203.
- 44. 中华人民共和国药典2010版三部: 人用狂犬病疫苗(地鼠肾细胞), 115-118.
- 45. 杨进业, 谢艺红, 莫兆军, 等. 广西狂犬病早死现象的研究[J]. 广西预防医学杂志, 2005(3): 143-146.
- 46. 张永振, 肖东楼, 孙玉辉, 等. 中国1984-2002年狂犬病流行情况和防制对策[J]. 中华流行病学杂志, 2003(10): 883-886.
- 47. 朱凤才, 祖荣强, 吴扬生, 等. 江苏省1990-2000年狂犬病流行情况和防制策略[J]. 中华流行病学杂志, 2001(1): 14-16.
- 48. 王树声. 一种新型的皮卡治疗性(PIKA)佐剂狂犬病疫苗——抢救生命的治性疫苗[J]. 应用预防医学, 2010(1): 1-4.