Studies in Synthetic Chemistry
Vol.03 No.03(2015), Article ID:16039,4
pages
10.12677/SSC.2015.33011
New Method for the Synthesis of 4-Thiothymidine
Defeng Yan, Lingshuang He, Kedong Ma, Xiaohui Zhang, Depeng Li
Institute of Environment and Chemical Engineering, Dalian University, Dalian Liaoning
Email: yandefeng1991@sina.com
Received: Aug. 29th, 2015; accepted: Sep. 13th, 2015; published: Sep. 16th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
4-Thiothymidine combined with UVA (light shading effect with long-wave ultraviolet) as a potentially novel therapy for cancer provides a new way, UVA-sensitive 4-thiothymidine was obtained through the study of the modification of thiothymidine at 4-position, and reached the role of treatment of tumor cells under the synergy of UVA. In order to obtain 4-Thiothymidine drugs with new optical properties, triazole and P2S5 are used in previously reported methods. In this study, Lawesson reagent was adopted to prepare 4-thiothymidine. Under the optimized conditions, the reaction time was significantly reduced and the yield increased. The structure of the product was characterized by 1H-NMR and 13C-NMR.
Keywords:4-Thiothymidine, Lawesson Reagent, Synthesis, Antitumor Activity
4-硫胸苷的合成新方法
闫德峰,赫玲爽,马克东,张晓辉,李德鹏
大连大学环境与化学工程学院,辽宁 大连
Email: yandefeng1991@sina.com
收稿日期:2015年8月29日;录用日期:2015年9月13日;发布日期:2015年9月16日

摘 要
4-硫胸苷/UVA(长波黑斑效应紫外线)辅助疗法为癌症治疗提供了新的途径,通过对胸苷进行修饰,得到对近紫外光敏感的药物,从而在紫外光的协同作用下达到治疗肿瘤细胞的作用。为了得到新型具有光学性质的4-硫胸苷类药物,传统使用三唑法和P2S5法,而本文采用了新试剂——Lawesson试剂,极大的缩短了反应时间,提高了产率,并用1H-NMR及13C-NMR表征了产物结构。
关键词 :4-硫胸苷,Lawesson试剂,合成,抗肿瘤活性

1. 引言
核酸(DNA和RNA)是重要的生物大分子,在生命过程中拥有关键作用。除了一些病毒外,DNA是所有物种的遗传物质。DNA中有四种脱氧核苷用于存储遗传信息,分别是腺嘌呤脱氧核苷、胸腺嘧啶脱氧核苷、胞嘧啶脱氧核苷、鸟嘌呤脱氧核苷。然而DNA碱基和核苷很容易受到化学、物理和生物作用的损坏,这也是癌症成为现代社会人类生命首要威胁的原因之一[1] 。从上个世纪四十年代起,对核苷类似物的活性研究成为重要的研究领域。阿昔洛韦(Aciclovir)作为人工合成的抗疱疹病毒药物,具有选择性强和细胞毒性低的优点,其发明者美国药理学家Gertrude Belle Elion于1988年获诺贝尔医学奖。它的问世被视为抗病毒治疗的新时代,极大的激励了核苷类似物的人工合成研究,并得到大量化学修饰的核苷类似物[2] -[4] 。5-取代胸苷类似物作为抗肿瘤和抗病毒药物已被广泛用于临床[5] ,例如5-氟脱氧尿苷(FdU)、5-溴脱氧尿苷(BrdU)、5-碘脱氧尿苷(IdU),它们可用作抗为肿瘤药物和潜在的增敏剂以增强肿瘤细胞对射线的灵敏度[6] [7] 。研究发现4-硫代核苷类似物具有与自然核苷相类似的结构,但其紫外吸收波长有很大不同。4-硫代核苷类似物对紫外线更敏感,胸苷的最大吸收波长在270 nm,4-硫胸苷在336 nm有最大吸收波长[8] ,实验表明它能杀死癌细胞,可作为潜在抗肿瘤药物,尤其是与UVA结合后可用于治疗皮肤癌,且当5-位取代基能与嘧啶环共轭时,效果更好[8] [9] 。这一性质可能来源于光交叉偶联反应和DNA-蛋白质交叉偶联反应[10] 。因此,徐耀忠等人提出一种新的光化学治疗方法,即紫外光辅助4-硫胸苷疗法(4-硫胸苷/UVA疗法)。硫代胸苷可进入肿瘤细胞的DNA中,通过UVA照射并相互作用达到损伤无限增长的细胞的DNA的作用。研究表明,低剂量的紫外光与4-硫胸苷结合后,可以有效杀死癌细胞,并对正常细胞没有毒害[11] 。鉴于硫代核苷的独特优势,合成更多具有生物活性的抗癌药物成为迫切要求。
用于合成硫代核苷试剂的方法有很多,但是Lawesson试剂法有更多的优点,Lawesson试剂分子含有硫和磷交替组成的四元环结构。加热时发生解聚,生成两个不稳定的硫代磷叶立德(R-PS2),它们是主要的反应活性中间体。
2. 实验部分
2.1. 仪器与试剂
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司),SZCL-3B型智能控温磁力搅拌器(巩义市予华仪器有限公司),RE-52C旋转蒸发器(巩义市予华仪器有限公司),SHZ-D(Ⅲ)循环水式多用真空泵(巩义市予华仪器有限公司),X-4数字显示显微熔点测定仪(北京泰克仪器有限公司),试剂为化学纯或分析纯,1,4-二氧六环和吡啶使用之前已做过无水处理。
2.2. 4-胸苷的合成路线(图1)
2.2.1. 3’,5’-O-二氧乙酰基胸苷的合成
把胸苷(1) (2.84 g, 11.64 mmol)加入到250 mL三口烧瓶中,用无水吡啶(60.6 mL, 753 mmol)充分溶解,搅拌,加入纯度为97%的乙酸酐(12.45 mL, 131.7 mmol),冰浴条件下,反应12 h以上,用TLC(薄层色谱)检测,至原料点消失,停止反应。减压条件下60℃~70℃除去溶剂,再加入CH2Cl2和苯各20 mL,在减压下再次除去溶剂。粗产品溶于CH2Cl2 (300 mL)中,再加入饱和NaHCO3 (100 mL),用CH2Cl2分别萃取3次,并把有机相合并,用无水Na2SO4干燥,抽滤,最后用甲醇重结晶,得到白色晶体3’,5’-O-二氧乙酰基胸苷(2) (3.62 g, 14.00 mmol),收率为95%,熔点(m.p.)为126℃~127℃(文献值126℃~128℃) [12] 。1H NMR (500 MHz, DMSO-d6 ) δ:11.39 (br s, 1H, NH),7.50 (s, 1H, 6-H),6.18 (t, J = 8.0 Hz, 1H, 1’-H),5.18 (t, J = 4.0 Hz, 1H, 3’-H),4.25 (d, J = 4.0 Hz, 2H, 5’-H),4.14 (d, J = 4Hz, 1H, 4’-H),2.25~2.48 (m, 2H, 2’-H),2.07 (s,6H, 2 × −OC = OCH3),1.80 (s, 3H, −CH3)。
2.2.2. 3’,5’-O-二氧乙酰基-4-硫胸苷的合成
把3’,5’-O-二氧乙酰基胸苷(2.0 g, 6.12 mmol) (2)加入到250 mL三口瓶中,用无水1,4-二氧六环(110 mL, 1.29 mol)充分溶解,再加入Lawesson试剂(2.0 g, 4.94 mmol),充分搅拌,安装回流装置,并用Ar气保护,升温至95℃,回流约2.5 h,用TLC[V(石油醚):V(乙酸乙酯) = 1:1]检测,直至反应点完全消失,停止反应。减压除去溶剂,粗产品通过硅胶层析分离,洗脱剂为V(石油醚):V(乙酸乙酯) = 6:1。得到黄色块状固体3’,5’-O-二氧乙酰基-4-硫胸苷(3) (1.89 g, 8.59 mmol),收率为64%,熔点(m.p.)为94℃~96℃(文献值97℃) [13] 。1HNMR (500 MHz, DMSO-d6) δ:12.79(br s, 1H, NH),7.36 (s, 1H, 6-H),6.13 (t, J = 4.0 Hz, 8. 0 Hz, 1H, 1’-H),5.21 (t, J =4.0 Hz, 1H, 3’-H),4.26 (dd, J =4.0 Hz, 2H,5’-H),4.20~4. 21 (m, 1H, 4’-H),2.32~2.48 (m, 2H, 2’-H),2.06 (s, 3H, −OC=OCH3 ),2.07 (s, 3H, −OC = OCH3),1.99 (s, 3H, −CH3)。
2.2.3. 4-硫胸苷的合成
把3’,5’-O-二氧乙酰基-4-硫胸苷(1.4 g, 4.06 mmol)加入到500 mL单口瓶中,用饱和的氨气甲醇溶液(266 mL, 6.03 mmol)充分溶解,室温下搅拌2 h,用TLC[V(二氯甲烷):V(甲醇) = 9:1]检测,直至反应点完全消失,停止反应。减压除去溶剂,粗产品通过硅胶层析分离,洗脱剂为V(二氯甲烷):V(甲醇) = 30:1。得到黄色粉末状4-硫胸苷(4) 0.92 g,收率为88%,熔点(m.p.)为115℃(文献值116℃~118℃) [14] 。1H NMR (500 MHz, DMSO-d6) δ:12. 70 (br s, 1H, NH),7. 89 (s, 1H, 6-H),6.11 (t, J = 4.0 Hz, 8.0 Hz, 1H, 1’-H),5.09 (s, 1H, 5’-OH),526 (s, 1H, 3’-OH),3.80 (d, J = 4.0 Hz, 1H, 4’-H),4.25 (s, 1H, 3’-H),3.59 (dd, J = 12 Hz, 24 Hz, 2H, 5’-H ),2. 14 (t, J =4 Hz, 12 Hz, 2H, 2’-H),1.97 (s,3H, −CH3 );13C NMR (DMSO-d6 , 500MHz) δ:190. 07,147.26,132.80,117.07,87.05,84.08,69.46,60.42,39.50,16.35。
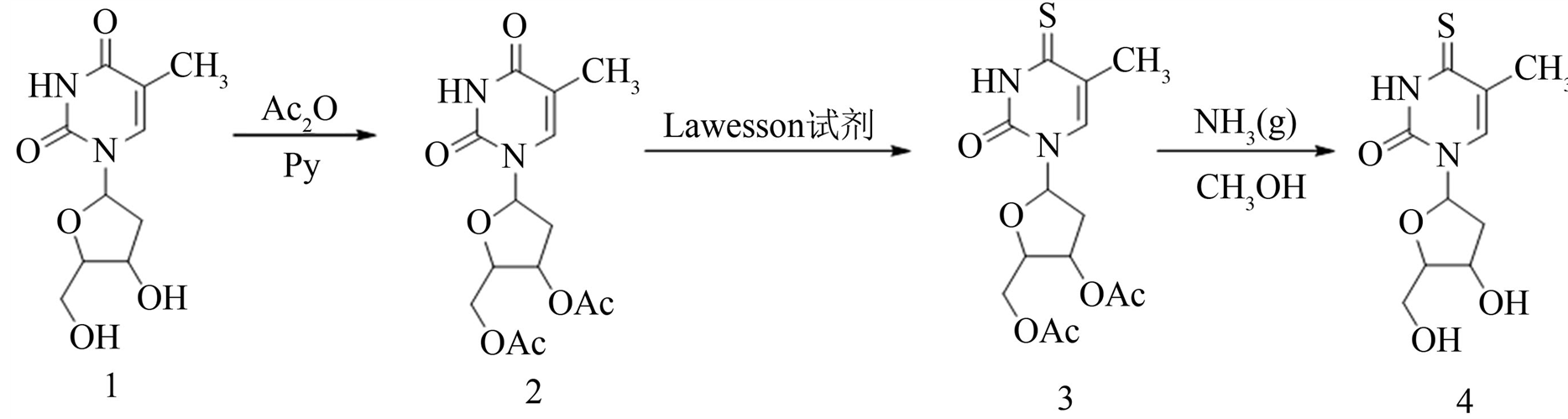
Figure 1. The synthetic route of 4-thiothymidine
图1. 4-硫胸苷的合成路线
3. 结果与讨论
本实验用Lawesson试剂代替了传统的三唑法和P2S5法,一方面在进行硫化步骤时,三唑法和P2S5法要反应6 h以上甚至过夜,但是Lawesson试剂法只需2.5 h即可反应完全,极大的降低了反应时间。与银鸿雁等[15] 的报道相比,收率由51%提高至64%,由于原料回收难度较大,很难再利用,从而也就减少了胸苷等昂贵资源的浪费。另一方面相对于P2S5法来说,所用含硫试剂更少,对减少环境污染,也有一定的意义。在使用Lawesson试剂反应之后,进行硅胶柱分离时,Lawesson试剂的一部分杂质,用纯的石油醚即可过滤出来,这样会使分离过程变得更加简便快捷,从而使的得到的产物更加纯净。
在整个反应过程中,由于胸苷类似物对温度比较敏感,所以在蒸干所有溶剂的过程中,要控制温度,不宜太高,同时,由于我们的目标产物对水也十分敏感,所以在反应前,要确保原料干燥无水,并且溶剂都应做好无水处理,否则会致使产率较低甚至反应失败。
文章引用
闫德峰,赫玲爽,马克东,张晓辉,李德鹏. 4-硫胸苷的合成新方法
New Method for the Synthesis of 4-Thiothymidine[J]. 合成化学研究, 2015, 03(03): 70-73. http://dx.doi.org/10.12677/SSC.2015.33011
参考文献 (References)
- 1. Lindahl, T. (1993) Instability and decay of the primary structure of DNA. Nature, 362, 709-715. http://dx.doi.org/10.1038/362709a0
- 2. Ichikawa, E. and Kato, K. (2001) Advance in synthesis of sug-ar-modified nucleosides in past 10 years. Organic Synthesi. Bulletin of the Chemical Society of Japan, 59, 331-345.
- 3. Porcher, S. and Pitsch, S. (2005) Synthesis of 2’-O-[(triisopropylsilyl)oxy] methyl protected ribonucleoside phosphoramidites containing various nucleobase analogues. Helvetica Chimica Acta, 88, 2683-2704. http://dx.doi.org/10.1002/hlca.200590209
- 4. Lakshman, M.K. (2005) Azide-tetrazole equilibrium of C-6 azidopurine nucleosides and their ligation reactions with alkynes. Current Organic Synthesis, 2, 83-112. http://dx.doi.org/10.2174/1570179052996955
- 5. Wigerinck, P., Pannecouque, C., Snoeck, R., et al. (1991) 5-(5-Bromothien-2-yl)-2'-deoxyuridine and 5-(5-chlorothien- 2-yl)-2'-deoxyuridine are equipotent to (E)-5-(2-bromovinyl)-2'-deoxyuridine in the inhibition of herpes simplex virus type I replication. Journal of Medicinal Chemistry, 34, 2883-2389. http://dx.doi.org/10.1021/jm00112a011
- 6. Erikson, R.L. and Szybalski, W. (1963) 5-Iodo-2’-Deoxyuridine. Radiation Research, 20, 252-622. http://dx.doi.org/10.2307/3571531
- 7. Franken, N.A., Van Bree, C., Veltmaat, M.A., Rodermond, H.M., Haveman, J. and Barendsen, G.W.J. (2001) Analysis of linear and quadratic parameters of radiation survival curves of two human tumor cell lines. Journal of Radiation Research (Tokyo), 42, 179-190.
- 8. Pridgeon, S.W., Heer, R., Taylor, G.A., et al. (2011) Thiothymidine combined with UVA as a potential novel therapy for bladder cancer. British Journal of Cancer, 104, 1869-1876. http://dx.doi.org/10.1038/bjc.2011.180
- 9. Gemenetzidis, E., Shavorskaya, O., Xu, Y.Z., et al. (2013) Topical 4-thiothymidine is a viable photosensitiser for the photodynamic therapy of skin malignancies. Journal of Dermatological Treatment, 24, 209-214. http://dx.doi.org/10.3109/09546634.2011.631978
- 10. Reelfs, O., Karran, P. and Young, A.R. (2012) 4-Thiothymidine sensitization of DNA to UVA offers potential for a novel photochemotherapy. Photochemical & Photobiological Sciences, 11, 148-154. http://dx.doi.org/10.1039/C1PP05188A
- 11. Massey, A., Xu, Y.Z. and Karran, P. (2011) Photoactivation of DNA thiobases as a potential novel therapeutic option. Current Biology, 11, 1142-1146. http://dx.doi.org/10.1016/S0960-9822(01)00272-X
- 12. Raffaele, S., Claudia, C., Occhionero, F., et al. (1995) A new chemical transformation of 4-thiouracil and 6-thiogu- anine nucleosides to cytosine and adenosine counterparts. Tetrahedron, 51, 3607-3616. http://dx.doi.org/10.1016/0040-4020(95)00076-K
- 13. Scheit, K.H. (1968) Die synthese von 4-thiouridin-5’-diphosphat, 4-thiouridin-5’-triphosphat. Chemische Berichte, 101, 1141-1147. http://dx.doi.org/10.1002/cber.19681010402
- 14. Sara, V.P., Helene, M.L, Olivier, H., et al. (2011) Synthesis and inhibitory activity of thymidine analogues targeting mycobacterium tuberculosis thymidine monophosphate kinase. Bioorganic & Medicinal Chemistry, 19, 7603-7611.
- 15. 银鸿雁, 郑学仿, 曹洪玉, 张晓辉 (2013) 4-硫胸苷的合成及其与人血清白蛋白的相互作用. 发光学报, 1, 104-110.