 Hans Journal of Chemical Engineering and Technology 化学工程与技术, 2012, 2, 103-107 http://dx.doi.org/10.12677/hjcet.2012.24018 Published Online October 2012 (http://www.hanspub.org/journal/hjcet.html) Study on CO2 Absorption with Aqueous Potassium Carbonate Solution Promoted by Boric Acid* Shufeng Shen#, Xiao xia Feng Hebei Research Center of Pharmaceutical and Chemical Engineering, School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang Email: #shufengshen@gmail.com Received: Aug. 8th, 2012; revised: Sep. 3rd, 2012; accepted: Sep. 10th, 2012 Abstract: The addition of promoter into aqueous potassium carbonate solution is one of the effective ways to enhance the CO2 absorption rate. In this work, the CO2 absorption rates were investigated for aqueous carbonate solution pro- moted by different addictives in a wetted wall column. The effect of concentration of boric acid on the overall gas-phase mass transfer coefficient and vapor-liquid equilibrium data was discussed. Results showed that the addition of boric acid can significantly enhance the CO2 absorption rate. The overall mass transfer coefficient increased by 80% with the addition of 3 wt% boric acid. CO2 partial pressure increased with the increasing temperature of aqueous potassium car- bonate. However it decreased when boric acid was added, which would be favorable for CO2 absorption. Keywords: Carbon Dioxide Absorption; Potassium Carbonate; Boric Acid; Vapor-Liquid Equilibrium 硼酸活化碳酸钾溶液吸收 CO2的研究* 申淑锋#,冯晓霞 河北科技大学化学与制药工程学院,河北省药物化工工程技术研究中心,石家庄 Email: #shufengshen@gmail.com 收稿日期:2012 年8月8日;修回日期:2012 年9月3日;录用日期:2012 年9月10 日 摘 要:加入活化剂是提高碳酸钾溶液吸收 CO2速率的有效方法。在湿壁柱中研究不同活化碳酸钾溶液吸收CO2 的效果基础上,考察了不同硼酸浓度对碳酸钾吸收 CO2速率的影响,测定了活化液的气液平衡数据。结果表明 加入硼酸能够明显提高CO2吸收速率,3 wt%硼酸可将总传质系数提高约 80%;碳酸钾溶液随着温度升高 CO2 平衡分压升高,加入硼酸后比相同条件下碱液的 CO2平衡分压略低,有利于二氧化碳吸收。 关键词:二氧化碳吸收;碳酸钾;硼酸;气液平衡 1. 引言 以温室气体排放引起的全球气候变化问题日益 严重,成为当今国际社会关注的热点。据国际能源署 报道,2010 年世界 CO2排放量达到331.6 亿吨,约 60% 的温室效应由 CO2引起。CO2捕获和封存作为 2050 年温室气体减排目标最重要的技术方向。化学溶剂吸 收法是近期燃煤电厂有望实现 CO2捕获的有效途径之 一[1]。采用碳酸钾溶液(钾碱液)体系捕获CO2在很多 方面具有明显的优势[2-5]:具有低吸收热;溶剂成本低; 耐氧化及 SOX、NOX杂质能力强;无毒、无化学降解、 无挥发性等。但是在常压和较低温度范围内存在吸收 反应速率慢的限制[2]。开发性能良好的活化剂是该领 域一直关注的焦点。有机胺类活化剂如乙醇胺、哌嗪 等在常温下能与二氧化碳迅速反应,促进了钾碱液吸 *资助项目:河北省自然科学基金(B2012208022)和国家自然科学基 金(21206029)。 #通讯作者。 Copyright © 2012 Hanspub 103  硼酸活化碳酸钾溶液吸收 CO2的研究 收过程[4-6]。但是存在溶剂成本高、吸收热和再生能耗 高、易热降解、热稳定盐形成和腐蚀性等不利因素的 影响。一些无机活化剂如亚砷酸、五氧化二钒等尽管 能够明显提高反应速率,但由于溶液的高毒性和致癌 作用,在推广应用中受到了一定的限制[7,8]。硼酸具有 低毒、无降解、环境友好等优点,广泛地存在于自然 界中。近年来对硼酸的研究受到了重视,也进行了硼 酸对碳酸盐溶液吸收 CO2速率的影响和部分基础研究 的工作[9-12]。但是有关硼酸活化钾碱液的动力学、气 液平衡及物性数据等仍非常缺乏,开展这方面的基础 研究有重要的意义。 本研究考察了硼酸与其它活化剂的活化效果,同 时考察了不同温度下硼酸的加入对碳酸钾溶液气液 平衡的影响。研究结果对于计算硼酸本征动力学、动 力学模型的建立以及相应的工艺的设计、优化和操作 将有很大的帮助。 2. 实验部分 2.1. 化学试剂 硼酸(以H3BO3计)为分析纯,购买于上海晶纯实 业有限公司。碳酸钾、氢氧化钾、硅酸钾、钼酸钠、 硫酸(98%)均为分析纯试剂。N2和CO2为高纯气体购 于石家庄西三教制氧站。 2.2. 实验装置及流程 试验采用湿壁柱研究不同吸收液吸收 CO2的速 率,装置示意图如图1所示。 N2和CO2分别由质量流量控制仪(D07-7B/北京七 星华创)控制得到混合气体(约18% CO2)依次进入置于 超级恒温槽(CH30/上海方瑞)中的缓冲罐、饱和器后, 由湿壁柱底部进入与不锈钢管内的顶部溢流吸收液 逆流接触后由上部流出,经过两次冷凝后进入CO2红 外气体分析仪(H3860/北京华和天地)。反应后吸收液 从湿壁柱低部流出经泵打入贮槽中。 气液平衡数据测定实验流程示意图如图 2所示。 控制 N2流量为1.0 L/h,经水饱和器后在串联的平衡 罐内与一定 CO2负载的吸收液接触,当气相与液相达 到平衡后(约2 h),经过冷凝后使用红外气体分析仪 (H3860/ 北京华和天地)分析气相的组成,并采用酸碱 滴定的方法确定平衡液相中CO2的负载量。 1, 2——气瓶;3, 4——质量流量控制仪;5——缓冲罐;6——水饱和7——吸 收剂;8——湿壁柱;9, 10——冷凝器;11——CO2分析仪;12——贮槽;13 ——恒温水浴槽 Figure 1. Schematic diagram for carbon dioxide absorption in a wetted-wall column 图1. 湿壁柱吸收 CO2流程示意图 1——氮 气罐; 2——气体质量流量计;3——恒 温槽;4——水 饱和器;5, 6——平衡罐;7——压力变送器;8——取 样口;9 ——冷凝管;10——CO2分析仪;11——蠕动泵;12, 13——冷 凝槽;14, 15——温 度计 Figure 2. Vapor-liquid equilibrium apparatus 图2. 气液平衡试验装置 2.3. 分析方法 钾碱液吸收 CO2过程的反应速率大小可由总传质 系数 KG表示,即: 22 * COCO ,COGb NKPP 2 (1) 式中: :CO2的吸收速率,mo l/( m2·s); 2 CO N2 * CO P : CO2在吸收溶液体系中的平衡分压,Pa;P:CO2 在湿壁柱中的分压,可用对数平均分压 Plm 代替,Pa; KG:以气相分压差为推动力表示的总传质系数, mol / (m2·s Pa)。 2,bCO 气液平衡时气相中CO2分压( )是基于红外 气体分析仪测定的混合气体中 CO2的干基含量 ( )由公式(2) 计算获得。假定经水饱和器后平衡 罐中水份已达到测定温度(T)和压力(P)下的饱和状 2 * CO ,T P 2 CO ,d y Copyright © 2012 Hanspub 104 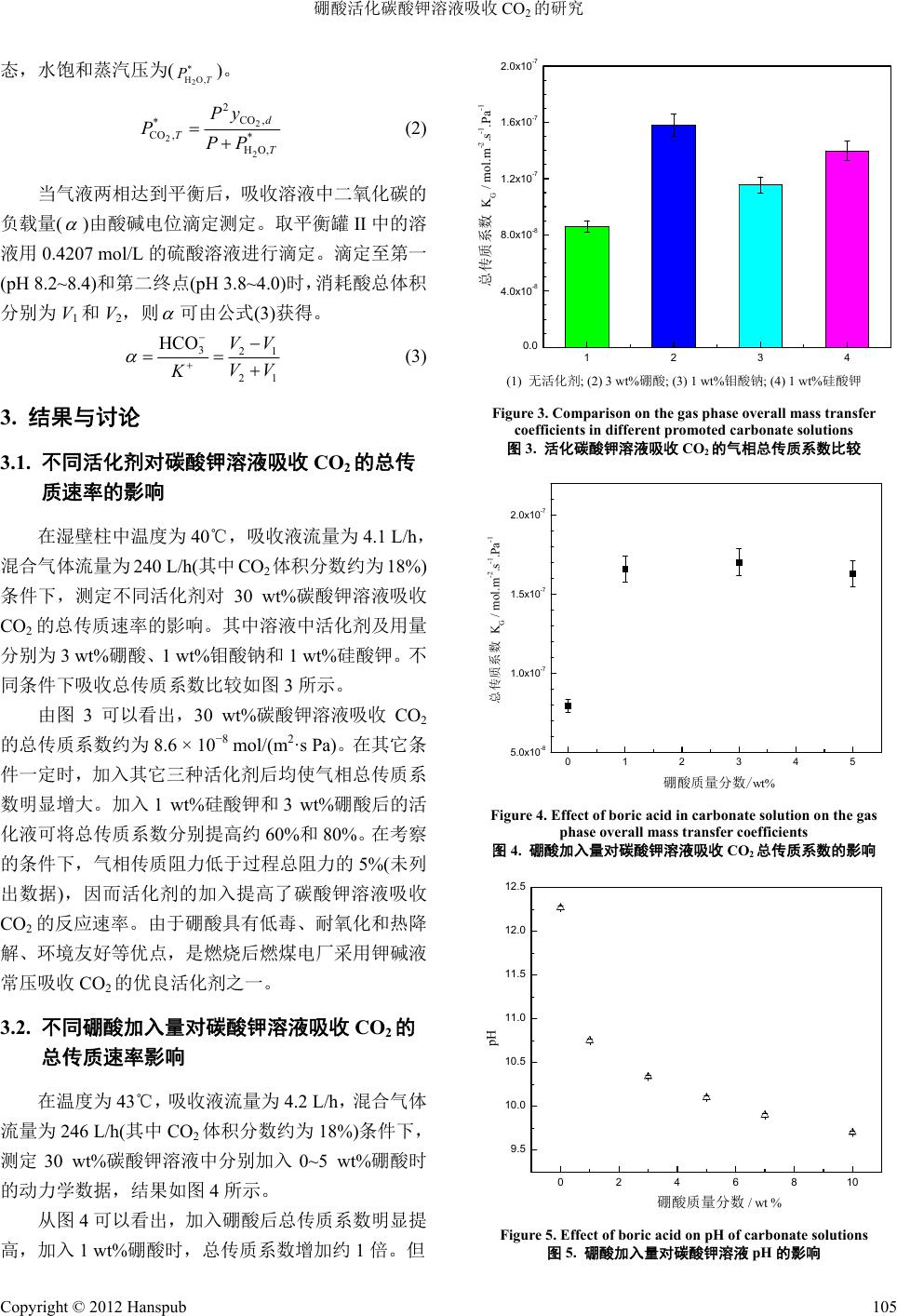 硼酸活化碳酸钾溶液吸收 CO2的研究 态,水饱和蒸汽压为( )。 2 * HO,T P 2 2 2 2 CO , * CO ,T* HO , d T Py PPP (2) 当气液两相达到平衡后,吸收溶液中二氧化碳的 负载量( )由酸碱电位滴定测定。取平衡罐II 中的溶 液用 0.4207 mol/L 的硫酸溶液进行滴定。滴定至第一 (pH 8.2~8.4)和第二终点(pH 3.8~4.0)时,消耗酸总体积 分别为 V1和V2,则 可由公式(3)获得。 3 HCO K 21 21 VV VV (3) 3. 结果与讨论 3.1. 不同活化剂对碳酸钾溶液吸收 CO2的总传 质速率的影响 在湿壁柱中温度为40℃,吸收液流量为 4.1 L/h, 混合气体流量为240 L/h(其中 CO2体积分数约为 18%) 条件下,测定不同活化剂对 30 wt%碳酸钾溶液吸收 CO2的总传质速率的影响。其中溶液中活化剂及用量 分别为 3 wt%硼酸、1 wt%钼酸钠和1 wt%硅酸钾。不 同条件下吸收总传质系数比较如图3所示。 由图 3可以看出,30 wt%碳酸钾溶液吸收 CO2 的总传质系数约为8.6 × 10−8 mol/(m2·s Pa)。在 其 它 条 件一定时,加入其它三种活化剂后均使气相总传质系 数明显增大。加入1 wt%硅酸钾和3 wt%硼酸后的活 化液可将总传质系数分别提高约60%和80%。在考察 的条件下,气相传质阻力低于过程总阻力的 5%(未列 出数据),因而活化剂的加入提高了碳酸钾溶液吸收 CO2的反应速率。由于硼酸具有低毒、耐氧化和热降 解、环境友好等优点,是燃烧后燃煤电厂采用钾碱液 常压吸收 CO2的优良活化剂之一。 3.2. 不同硼酸加入量对碳酸钾溶液吸收 CO2的 总传质速率影响 在温度为 43℃,吸收液流量为4.2 L/h,混合气体 流量为 246 L/h(其中CO2体积分数约为18%)条件下, 测定 30 wt%碳酸钾溶液中分别加入0~5 wt%硼酸时 的动力学数据,结果如图4所示。 从图 4可以看出,加入硼酸后总传质系数明显提 高,加入 1 wt%硼酸时,总传质系数增加约1倍。但 1234 0.0 4.0x10-8 8.0x10-8 1.2x10-7 1.6x10-7 2.0x10-7 总传质系数 KG / mol.m-2.s-1.Pa-1 (1) 无活化剂; (2) 3 wt%硼酸; (3) 1 wt%钼酸钠; (4) 1 wt%硅酸钾 Figure 3. Comparison on the gas phase overall mass transfer coefficients in different promoted carbonate solutions 图3. 活化碳酸钾溶液吸收 CO2的气相总传质系数比较 012345 5.0x10-8 1.0x10-7 1.5x10-7 2.0x10-7 硼酸质量分数/wt% 总传质系数 KG / mol.m-2.s-1.Pa-1 Figure 4. Effect of boric acid in carbonate solution on the gas phase overall mass transfer coefficients 图4. 硼酸加入量对碳酸钾溶液吸收 CO2总传质系数的影响 0246810 9.5 10.0 10.5 11.0 11.5 12.0 12.5 pH 硼酸质量分数 / wt % Figure 5. Effect of boric acid on pH of carbonate solutions 图5. 硼酸加入量对碳酸钾溶液 pH的影响 Copyright © 2012 Hanspub 105  硼酸活化碳酸钾溶液吸收 CO2的研究 在考察的硼酸加入量范围内,硼酸在溶液中的浓度变 化对总传质系数无显著的影响。这可能是由于硼酸加 入碳酸钾溶液后 pH 值的变化等综合因素影响的结 果。图 5为室温下碳酸钾溶液中加入0~10 wt%硼酸后 pH 的变化情况。 从图 5可以看出,随着硼酸加入量的增加,碳酸 钾溶液的 pH 值迅速降低,当加入量超过3 wt%时, pH 变化幅度明显减小。由于硼酸(B(OH)3)加入后在钾 碱溶液中电离平衡主要以 存在,进而使溶液 中OH−离子溶度变化导致溶液的 pH 值降低。硼酸活 化钾碱液吸收 CO2的主要反应机理[2,12]可由式(4)~(8) 表示。其中未添加活化剂的纯碳酸钾溶液通过反应(4) 和(5)吸收 CO2。在 pH > 10 的溶液中,反应(5)比较慢 (298 K 时k = 0.026 s−1)通常可以忽略[13],此时反应(4) 为主要反应,溶液中 OH−浓度对 CO2吸收有重要的影 响。硼酸加入后主要通过穿梭机理(反应(6)和(7))加快 CO2吸收。Guo 等人[12]也指出硼酸在溶液中促进作用 与密切相关。硼酸加入量对总 传质系数的影 响是和 OH−与CO2反应共同作用的结果,因 而表观传质速率变化不大(图4)。 4 B(OH) 4 B(OH) B(OH)4 2 CO OHHCO 3 3 (4) + 22 3 COH OHCOH (5) 42 42 B(OH)CO[B(OH)CO ] (6) 42 23 [B(OH)CO]HOB(OH)HCO (7) 34 B(OH) OHB(OH) (8) 3.3. 活化碳酸钾溶液的气液平衡 在温度为 30℃~70℃范围内,测定 30 wt%碳酸钾 溶液、加入 2.5 wt%硼酸的 30 wt%碳酸钾溶液和加入 2.2 wt%硼酸的 35 wt%碳酸钾溶液在不同负载条件下 的气液相平衡数据。 CO2平衡分压与液相负载量关系的 实验结果以及 ASPEN 模拟的平衡数据如图 6所示。 图6可以看出,保持氮气流量不变的条件下,体 系达到平衡后溶液的二氧化碳的平衡分压均随着温 度升高而呈上升趋势。负载量低于 0.30 时,考察溶液 的平衡分压均低于0.8 kPa,远低于燃烧后燃煤电厂烟 气中 CO2分压(约12 kPa)。30 wt%碳酸钾溶液获得的 平衡分压与文献报道的模拟数据接近[11]。在313 K时, 加入 2.5 wt%硼酸后二氧化碳的平衡分压与未活化溶 0.10 0.15 0.20 0.250.30 0.35 0 400 800 1200 323K 30 wt%碳酸钾 30 wt%碳酸钾+2.5 wt%硼酸 35 wt%碳酸钾+2.2 wt%硼酸 ASPEN模拟 30 wt%碳酸钾 (313K) ASPEN模拟 30 wt%碳酸钾 (323K) CO2 partial pressure / Pa CO2 loading 313K Figure 6. The partial pressure of CO2 over promoted potassium carbonate solution with different CO2 loading 图6. 活化碳酸钾溶液的 CO2平衡分压 液的平衡分压相当。但在平衡温度为323 K 时,加入 硼酸后二氧化碳的平衡分压略低,可提高过程推动力 进而有利于传质过程。加入硼酸后平衡分压的变化对 于过程设计、模拟传质和放大有很大的影响,需要进 一步完善数据以便用于实践。 4. 结论 本论文采用湿壁柱装置对比了不同活化剂加入 碳酸钾溶液时吸收CO2的效果,测定了部分气液相平 衡数据,结论如下: 1) 硼酸为钾碱液吸收 CO2的良好活化剂。3 wt% 硼酸可将总传质系数提高约80%。 2) 加入硼酸时吸收总传质系数明显增加,溶液 pH 减低。当加入量超过1 wt%时对总传质系数无明显 的影响。表观结果很可能是和OH−与CO2反 应共同作用的影响。 4 B(OH) 3) 碳酸钾溶液随着温度升高 CO2平衡分压明显 升高,与文献数据一致;加入硼酸后比相同条件下碱 液的 CO2平衡分压略低,有利于二氧化碳吸收。 参考文献 (References) [1] 李芬芬, 杨永红, 杨成, 张文郁, 吴晋沪. 电厂烟气中二氧化 碳的捕获[J]. 化学工程与技术, 2011, 1(1): 4-10. [2] G. Astarita, D. W. Savage and J. M. Longo. Promotion of CO2 mass transfer in carbonate solutions. Chemical Engineering Sci- ence, 1981, 36(3): 581-588. [3] A. Khodayari. Experimental and theoretical study of carbon dioxide absorption into potassium carbonate solution promoted Copyright © 2012 Hanspub 106  硼酸活化碳酸钾溶液吸收 CO2的研究 Copyright © 2012 Hanspub 107 with enzyme. University of Illinois at Urbana-Champaign, 2010. [4] G. T. Rochelle, F. Seibert, F. Closmann, T. Cullinane, J. Davis, G. Goff, M. Hilliard and J. McLees. CO2 capture by absorption with potassium carbonate, final report. The University of Texas at Austin and the University of Regina, Saskatchewan, 2007. [5] 李建强, 张新 军, 陆诗建等. 碳酸钾-二乙烯三胺复合溶液吸 收烟气中 CO2实验研究[J]. 环境科学学报, 2011, 31(7): 1501- 1508. [6] J. T. Cullinane, G. T. Rochelle. Carbon dioxide absorption with aqueous potassium carbonate promoted by piperazine. Chemical Engineering Science, 2004, 59(17): 3619-3630. [7] M. M. Sharma, P. V. Danckwerts. Catalysis by brønsted bases of the reaction between CO2 and water. Transaction of the Faraday Society, 1963, 59: 386-395. [8] 乐清华, 徐晋林, 施亚钧. 五氧化二钒催化钾碱液吸收二氧 化碳的机理[J]. 物理化学学报, 1992, 8(6): 753-759. [9] M. Ahmadi, V. G. Gomes and K. Ngian. Advanced modelling in performance optimization for reactive separation in industrial CO2 removal. Seperation and Purification Technology, 2008, 63(1): 107-115. [10] U. K. Ghosh, S. E. Kentish and G. W. Stevens. Absorption of carbon dioxide into aqueous potassium carbonate promoted by boric acid. Energy Procedia, 2009, 1(1): 1075-1081. [11] K. Endo, Q. S. Nguyen, S. E. Kentish and G. W. Stevens. The effect of boric acid on the vapour liquid equilibrium of aqueous potassium carbonate. Fluid Phase Equilibria, 2011, 309(2): 109- 113. [12] D. Guo, H. Thee, G. Silva, J. Chen, W. Fei, S. Kentish and G. W. Stevens. Borate-catalyzed carbon dioxide hydration via the car- bonic anhydrase mechanism. Environmental Science & Technol- ogy, 2011, 45(11): 4802-4807. [13] S. Paul, K. Thomsen. Kinetics of absorption of carbon dioxide into aqueous potassium salt of praline. International Journal of Greenhouse Gas Control, 2012, 8: 169-179. |