World Journal of Cancer Research
Vol.07 No.02(2017), Article ID:20225,8
pages
10.12677/WJCR.2017.72008
The Experimental Study of Tumor Growth of Recombinant Protein Fused with Cardiac Troponin I and Artificial Peptide
Zhaoyang Liu1*, Jie Tian2, Fenghua Shi2, Jun Liu1, Xiao Liang1, Muxiu Tan2, Fengming Liu2*
1National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing
2Guangxi Medical Botanical Institute, Nanning Guangxi
Received: Apr. 1st, 2017; accepted: Apr. 15th, 2017; published: Apr. 20th, 2017

ABSTRACT
Objective: The effect of antitumor growth of recombinant cardiac troponin fusion protein composed of subunit I and artificial peptide, called CIS, was examined in this study. Methods: The CIS’s effect on the expressing of human vascular endothelial growth factor A (VEGF-A) was examined using Western blot assay in vitro, and matrix metallopeptidase 9 was studied with purified recombinant CIS protein. The effect of tumors growth treated with CIS was performed using several in vivo nude mice xenograft models. Results: There was an evident reduction on VEGF-A, MMP-9 when the human hepatocellular carcinoma cells MHCC97H were treated with purified CIS fusion protein, which was also shown in dose-dependent manner compared to the untreated control group. A significant inhibition of tumor growth rate was achieved in CIS treated nude mice compared to untreated control mice in 8 or 6 different nude mice xenograft models. Conclusions: The fusion protein CIS has shown the inhibitive effect on the tumor growth in our in vivo nude mice models, which could be mediated by the mechanism of CIS’s effect on the inhibition of VEGF-A, MMP-9. This work has built the foundation for the in-depth investigations on the CIS’s pharmaceutical application targeting the anti-tumor therapy.
Keywords:Recombinant Fusion Protein of Myocardial Troponin I (CIS), VEGF-A, MMP-9, Xenograft Tumor, Inhibition of Tumor Growth
基因重组心肌肌钙蛋白I融合蛋白抗肿瘤作用 实验研究
刘朝阳1*,田洁2,师凤华2,刘军1,梁萧1,谭木秀2,刘凤鸣2*
1国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,北京
2广西药用植物研究所,广西 南宁

收稿日期:2017年4月1日;录用日期:2017年4月15日;发布日期:2017年4月20日

摘 要
目的:研究基因重组心肌肌钙蛋白I 与人工短肽融合蛋白(CIS)对肿瘤生长的抑制作用。方法:用Western Blot法观察对人肝癌细胞MHCC97H的VEGF-A和VEGF-C、MMP-9的影响。用3种人肿瘤异位可移植瘤模型观察CIS在裸鼠体内对肿瘤生长的抑制作用。结果:CIS对MHCC97H细胞,CIS 200 mg/ml,48 h,对VEGF-A表达较肿瘤模型组显著减少,抑制率为23.8%。DDP 2 mg/ml,48 h,对VEGF-A表抑制率为25.8%。CIS 200 mg/ml,48 h,对MMP-9表达较肿瘤模型组减少显著,抑制率为18.1%,DDP 2 mg/ml,48 h,对MMP-9表达比较肿瘤模型组抑制率为12.6%。CIS H组和DDP组对VEGF-C表达抑制作用较弱。荷瘤鼠体内皮下移植瘤模型实验显示CIS (10 mg/kg,SC)处理组肿瘤生长缓慢,瘤体明显小于模型对照组,对人肝癌HCC9204肿瘤瘤重抑制率为54.13%,对人可移植性乳腺癌BCaP-37肿瘤瘤重抑制率为53.88%,对人可移植性结肠癌HCT116肿瘤瘤重抑制率为41.12%。结论:基因重组心肌肌钙I与人工短肽融合蛋白CIS对人肝癌细胞MHCC97H VEGF-A和MMP-9表达具有抑制作用。在体内,CIS融合蛋白可有效的抑制人可移植肿瘤细胞的生长,CIS抗肿瘤效应与抑制肿瘤组织中血管内皮生长因子的表达和人基质金属蛋白酶-9的表达有关。
关键词 :基因重组心肌肌钙蛋白融合蛋白,VEGF-A,MMP-9,人可移植瘤,肿瘤抑制作用

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
当今,恶性肿瘤虽然已进入多学科交叉的综合治疗时代,可化学方案的实施依然是恶性肿瘤最重要治疗手段,随着抗癌新药与新化疗方案的临床运用给恶性肿瘤患者带来了治疗受益,使临床缓解率有明显提高。但是,抗癌药物给患者带来治疗受益同时,也给患者带来了严重的不良反应。与传统的放、化疗比较,肿瘤血管抑制剂主要针对已经启动的肿瘤新生血管,其直接作用运动的及增殖活跃的毛细血管内皮细胞,胃肠道反应、肝肾功能损害小。寻找新型抗肿瘤血管生成药物是当前肿瘤治疗研究的热点。实验研究证明,在无血管状态下的恶性肿瘤生长直径很少超过
2. 材料与方法
2.1. 材料
1) 试剂与药品:RPMI-1640培养基,胎牛血清,胰蛋白酶购自Hyclone公司。注射用顺铂(冻干型,Cisplatin for Injection),规格20 mg/瓶,国药准字H20023461,生产日期2014年9月,有效期至2016年9月。紫素(紫杉醇注射液 Paclitaxel injection),规格5 ml: 30 mg北京协和药厂产品,批准文号国药准字H10980069,规格30 mg/5 ml/瓶,生产日期2015年3月,有效期至2017年2月。基因重组心肌肌钙蛋白I融合蛋白液(CIS) 4 mg/ml,SDS-PAGE法检测蛋白质纯度为96%,溶剂为20 mM PBS (150 mM NaCl), pH 7.4的缓冲液,−80℃冰箱保存。VEGF-A,VEGF-C,MMP-9抗体,BCA蛋白定量试剂盒,山羊抗小鼠IgG,山羊抗兔IgG,β-actin鼠单抗由德元国际提供。
2) 细胞:MHCC97H肝癌细胞,人可移植性肝癌HCC9204细胞株,人可移植性乳腺癌BCaP-37细胞株,人可移植性结肠癌HCT116细胞株由北京中国医学科学院肿瘤研究所提供。
3) 动物:Balb/C裸鼠,雄,16~18 g,SPF级动物,中国食品药品检定研究院提供,实验动物质量合格证号SCXK(京)2014-0013。
2.2. 方法
1) 人心肌肌钙蛋白I融合蛋白(CIS)体外表达纯化
本实验研究制品由常州博闻迪医药科技有限公司提供,是以心肌肌钙蛋白I亚基为母板,以人工短肽为融合序列而合成的融合蛋白(CIS),构建于PET21a载体中,原核表达产物29 KDa的蛋白,SDS-PAGE法检测蛋白质纯度为96%,溶剂为20 mM PBS (150 mM NaCl), pH 7.4的缓冲液。
2) Western Blot法检测基因重组心肌肌钙蛋白I融合蛋白对人肝癌细胞MHCC97H VEGF-A、VEGF-C、MMP-9的影响
取对数生长期MHCC97H肝癌细胞分为4组,肝癌模型对照、阳性药顺铂(2 mg/ml培养液,作用48小时)、CIS低剂量(100 mg/ml培养液,作用48小时)、CIS高剂量(200 mg/ml培养液,作用48小时)。分别收集各瓶上清液和细胞,离心10分钟,3000转,分别保存沉淀进行细胞蛋白抽提,BCA法蛋白定量,SDS-PAGE电泳,转膜,洗膜,二抗孵育,显色后紫外灯下观察结果。采用凝胶图像分析系统对电泳条带分析。
3) CIS对人肝癌细胞株HCC9204裸鼠移植瘤抑制作用
将裸鼠皮下接种传代生长良好肿瘤制备瘤细胞液,每只鼠右前腋下皮下接种6 × 106细胞,然后随机分为4组,每组8只。皮下注射给药,CIC816给药高剂量为10 mg/kg,低剂量5 mg/kg,实验组每日上下午固定时间各皮下注射给药一次,每日2次给药,2次给药时间间隔4~6小时,连续共12天,实验开始后每4日用卡尺测皮下瘤长径和短径。阳性对照药紫素动物腹腔注射给药,每周给药3次,隔天1次,25 mg/kg体重。实验组末次给药后24小时处死动物,称体重后完整剥离瘤结并称瘤重,计算肿瘤抑制率并绘肿瘤生长曲线。
肿瘤抑制率 = CIS实验组瘤体组织重量/PBS对照组瘤体组织重量 × 100%。
肿瘤体积 = (长径 × 短径2)/2,以时间为横轴,肿瘤体积为纵轴,绘制肿瘤生长曲线。
4) CIS对人乳腺癌细胞株BCaP-37裸鼠移植瘤抑制作用
取已在裸鼠体内传代生长良好人可移植性乳腺癌BCaP-37细胞肿瘤结节,无菌操作制成瘤细胞液,接种于裸鼠腋窝皮下,步骤同实验(3)。
5) CIS对人结肠癌细胞株HCT116裸鼠移植瘤抑制作用
取已在裸鼠体内传代生长良好人可移植性HCT116肿瘤结节,无菌操作制成瘤细胞液,接种于裸鼠腋窝皮下,步骤同实验(3)。
2.3. 统计方法
实验结果用Office Excel软件进行统计学分析。所有数据以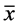 ± s表示,组间比较采用t检验,实验组肿瘤抑制率与对照组相比较,p < 0.05 具有统计学意义,p < 0.01(*) 具有显著统计学意义。
± s表示,组间比较采用t检验,实验组肿瘤抑制率与对照组相比较,p < 0.05 具有统计学意义,p < 0.01(*) 具有显著统计学意义。
3. 结果
1) Western blot法检测CIS对MHCC97H肝癌细胞VEGF-A和VEGF-C、MMP-9表达
用含有蛋白酶抑制剂的细胞裂解溶液裂解收集的细胞,经BCA蛋白质浓度测定试剂盒进行蛋白质定量。等量的细胞总蛋白(20 μg/泳道)上样进行12% SDS-PAGE电泳,显色后紫外灯下观察结果。采用凝胶图像分析系统,对电泳条带进行密度扫描后进行灰度分析。DDP组VEGF-A表达较肿瘤模型组明显减少,抑制率为25.8%。CIS L组VEGF-A抑制率为17.2%,CIS H组VEGF-A表达较肿瘤模型组显著减少,抑制率为23.8%。β-Actin表达在各组中无明显差异。DDP组MMP-9抑制率为12.6%。CIS L组MMP-9抑制率为13.2%,CIS H组MMP-9表达较肿瘤模型组减少显著,抑制率为18.1%。DDP组VEGF-C抑制率为9.2%。CIS H组VEGF-C表达抑制率为7.3%,结果见图1。

Figure 1. Expression of VEGF-A, MMP-9 and VEGF-C in hepatocellular carcinoma cell line MHCC97H by Western blot. (a) Expression of VEGF-A protein in each group was detected by Western blot; (b) Expression of MMP-9 protein in each group was detected by Western blot; (c) Expression of VEGF-C protein in each group was detected by Western blot. Lane 1,2: model control group; 3,4: DDP group; 5,6: CIS L group; 7,8: CIS H group
图1. Western blot法检测CIS对MHCC97H肝癌细胞VEGF-A、MMP-9和VEGF-C表达。(a) Western blot检测各组中VEGF-A蛋白的表达;(b) Western blot检测各组中MMP-9蛋白的表达;(c) Western blot检测各组中VEGF-C蛋白的表达。泳道1,2:模型对照组;泳道3,4:DDP组;泳道5,6:CIS L组;泳道7,8:CIS H组
光学倒置显微镜下观察可见:肝癌模型对照组细胞生长旺盛,细胞密集。DDP组肿瘤细胞明显减少。CIS L组较肿瘤模型组也明显减少,CIS H组较肿瘤模型组显著减少。结果见图2。
2) CIS对人肝癌细胞株HCC9204裸鼠移植瘤抑制作用
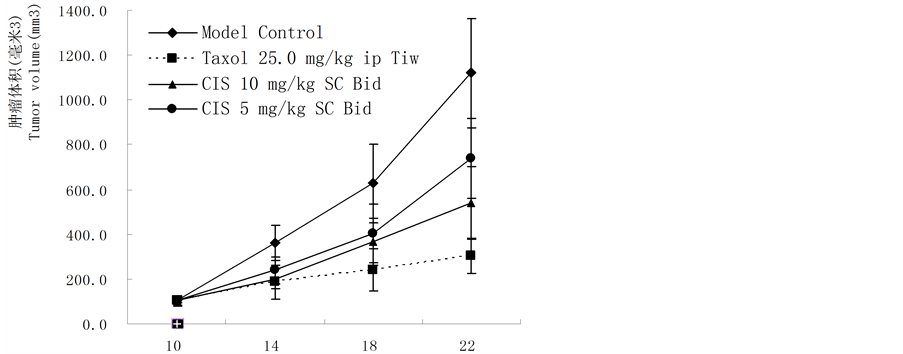
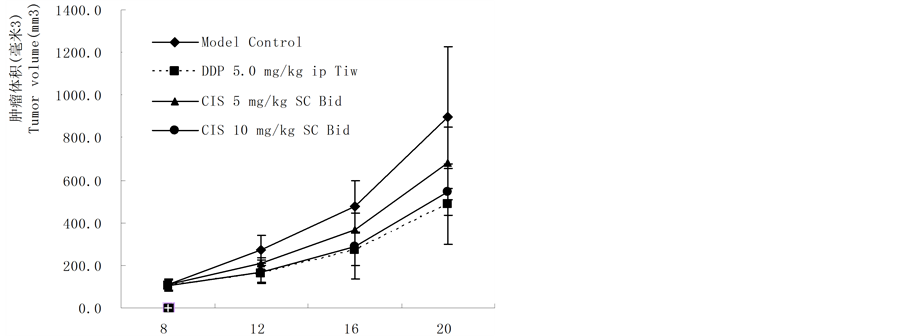
基因重组CIS液对裸鼠接种人肝癌HCC9204体内给药具有抑制作用,皮下注射(10 mg/kg和5 mg/kg,SC × 24)肿瘤抑制率分别为54.13%和35.86%,统计学比较,差异显著(P < 0.01,10 g/kg SC × 24),对照药紫素(25 mg/kg,ip × 6)肿瘤抑制率为72.28%,实验结果见表1、图3(a)和图3(b)。
3) CIS对人乳腺癌细胞株BCaP-37裸鼠移植瘤抑制作用
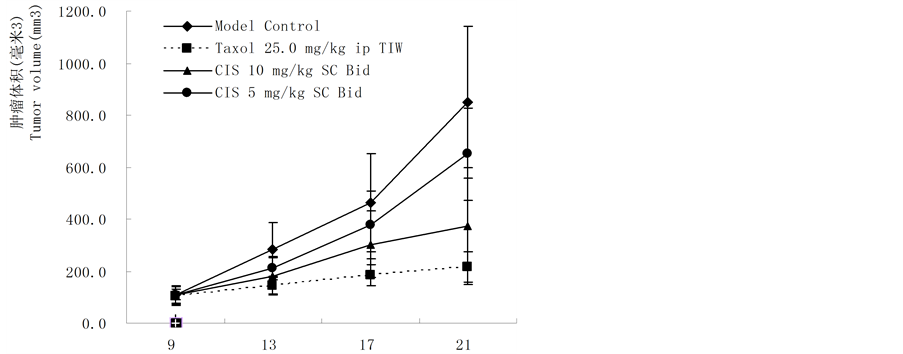
基因重组CIS液对人乳腺癌BCaP-37裸鼠体内给药具有抑制作用,皮下注射(10 mg/kg和5 mg/kg,SC × 24)肿瘤抑制率分别为53.88%和26.52%,统计学比较,差异显著(P < 0.001,10 g/kg SC × 24),对照药紫素(25 mg/kg,ip × 6)肿瘤抑制率为73.62%,实验结果见表2、图4(a)和图4(b)。
4) CIS对人结肠癌细胞株HCT116裸鼠移植瘤抑制作用
CIS液对裸鼠接种人结肠癌HCT116体内给药具有抑制作用,皮下注射(10 mg/kg和5 mg/kg,SC × 24)肿瘤抑制率分别为41.12%和32.02%,统计学比较,差异显著(P < 0.01,10 mg/kg SC × 24),对照药注射用顺铂(5 mg/kg,ip × 6)肿瘤抑制率为49.78%,实验结果见表3、图5(a)和图5(b)。

Figure 2. Effect of CIS on human hepatocellular carcinoma cell line MHCC97H in 48 hours scale bars represent 100 µm. (a) hepatocellular carcinoma cell line MHCC97H Control; (b) DDP 2 mg/ml for 48 h; (c) CIS 100 mg/ml for 48 h; (d) CIS 200 mg/ml for 48 h
图2. CIS对人肝癌细胞株MHCC97H细胞作用48小时后观察。(a)肝癌对照;(b) DDP,2 mg/ml,作用48小时;(c) CIS,100 mg/ml作用48小时;(d) CIS,200 mg/ml作用48小时
 (a) (b)
(a) (b)
Figure 3. (a) Tumor survival time after administration of CIS on nude mice bearing HCC9204 tumor (day); (b) Inhibition of CIS on transplanted human hepatoma HCC9204 cells in nude mice model
图3. (a) CIS液对裸鼠接种人可移植性肝癌HCC9204抑制作用;(b) CIS液对裸鼠接种人可移植性肝癌HCC9204抑制作用
 (a) (b)
(a) (b)
Figure 4. (a) Tumor survival time after administration of CIS on nude mice bearing BCaP-37 tumor (day); (b) Inhibition of CIS on transplanted human BCaP-37 cancer cells in nude mice model
图4. (a) CIS液对裸鼠接种人可移植性乳腺癌BCaP-37抑制作用;(b) CIS液对裸鼠接种人可移植性乳腺癌BCaP-37抑制作用
Table 1. Inhibition of CIS on transplanted human hepatoma HCC9204 cells in nude mice model
表1. CIS对裸鼠移植人可移植性肝癌HCC9204抑制作用
注:*:与对照组比较;NS:无菌0.9%氯化钠注射液;BID:每日2次;Tiw:每周3次隔日1次
 (a) (b)
(a) (b)
Figure 5. (a) Tumor survival time after administration of CIS on nude mice bearing HCT116 tumor (day); (b) Inhibition of CIS on transplanted human colonic carcinoma HCT116 in nude mice
图5. (a) CIS液对裸鼠接种人可移植性结肠癌HCT116抑制作用;(b) CIS液对裸鼠接种人可移植性结肠癌HCT116抑制作用
Table 2. Inhibition of CIS on transplanted human breast cancer BCaP-37 in nude mice model
表 2. CIS对裸鼠移植人可移植性乳腺癌BCaP-37抑制作用
注:*:与对照组比较;NS:无菌0.9%氯化钠注射液;BID:每日2次;Tiw:每周3次隔日1次
Table 3. Inhibition of CIS on transplanted human colonic carcinoma HCT116 in nude mice
表 3. CIS对裸鼠移植人可移植性结肠癌HCT116抑制作用
注:*:与对照组比较;NS:无菌0.9%氯化钠注射液;BID:每日2次;Tiw:每周3次隔日1次
4. 讨论
新血管生成在肿瘤的发生、发展过程中扮演重要的角色,可以为恶性肿瘤增殖提供必需的营养物质。抗肿瘤血管生成药物可针对以上各环节而起作用,抑制新生血管生成,切断肿瘤的营养供应以阻断肿瘤的生长和转移已成为防治肿瘤的新策略。多篇文献报道 [8] [9] [10] [11] ,重组人肌钙蛋白I和鲨鱼软骨提取的肌钙蛋白I具有抑制人血管内皮细胞增生、抑制新生血管生成、 抑制骨肉瘤细胞生长作用 [12] [13] [14] [15] [16] 。我们研究工作显示,重组人心肌肌钙蛋白I对裸鼠人移植瘤具有抗肿瘤作用。CIS是利用基因工程技术,以人心肌肌钙蛋白I为母板合成含有人心肌肌钙蛋白C的部分序列融合蛋白CIS,进行体外表达,纯化制备。实验表明对人肝癌HCC9204裸鼠移植瘤、人可移植性乳腺癌BCaP-37裸鼠移植瘤、人结肠癌HCT116裸鼠移植瘤显示54%~41%抑制率,体外对人肝癌细胞MHCC97H与血管生成有关的VEGF-A和VEGF-C、MMP-9显示一定的抑制作用,提示CIS有潜在应用前景,CIS抑制裸鼠移植瘤细胞的体内生长,对血管内皮细胞生长因子和金属蛋白酶-9具有抑制作用,为研究CIS融合蛋白的抗肿瘤应用提供基础。
基金项目
抗肿瘤新药基因重组CIS的研究开发,广西科学研究与技术开发计划(桂科攻14124004-2-14)。
文章引用
刘朝阳,田洁,师凤华,刘军,梁萧,谭木秀,刘凤鸣. 基因重组心肌肌钙蛋白I融合蛋白抗肿瘤作用实验研究
The Experimental Study of Tumor Growth of Recombinant Protein Fused with Cardiac Troponin I and Artificial Peptide[J]. 世界肿瘤研究, 2017, 07(02): 48-55. http://dx.doi.org/10.12677/WJCR.2017.72008
参考文献 (References)
- 1. 李元青, 马成杰, 刘朝阳, 陈信义. 茶多酚联合反应停对人肺腺癌A549抑制作用研究[J]. 现代生物医学进展, 2007, 7(9): 1281-1283.
- 2. 马成杰, 李元青, 刘朝阳, 陈信义, 孙颖立. 茶多酚联合重组人血管内皮抑制素(恩度)对人肺腺癌A549抑制作用研究[J]. 中国中医药信息杂志, 2008, 15(1): 41-43.
- 3. Moses, M.A., Wiederschain, D., Wu, I., et al. (1999) Troponin I Is Present in Human Cartilage and Inhibits Angiogenesis. Proceedings of the National Academy of Sciences of the United States of America, 96, 2645-2650. https://doi.org/10.1073/pnas.96.6.2645
- 4. 李渝萍, 陈敏, 陈彬, 等. 快速骨骼肌型肌钙蛋白I的研究进展[J]. 生命的化学, 2004, 24(3): 183-186.
- 5. Liu, X., Zhou, H. and Deng, X. (2007) Effect of Recombinant Human Troponin C on the Growth of Human Umbilicai Vein Endotheiiai Cells and Mouse Xenograft Tumor. Journal of Clinical Rehabilitative Tissue Engineering Research, 11, 7282-7285.
- 6. Feldman, L. and Rouleau, C. (2002) Troponin I Inhibits Capillary Endothelial Cell Proliferation by Interaction with the Cell’s bFGF Receptor. Microvascular Research, 63, 41-49.
- 7. Schmidt, K., Hoffend, J., Altmann, A., et al. (2006) Troponin I Overexpression Inhibits Tumor Growth, Perfusion, and Vascularization of Morris Hepatoma. The Journal of Nuclear Medicine, 47, 1506-1516.
- 8. Xie, Q., Yao, S., Chen, X., et al. (2012) A Polypeptide from Shark Troponin I Can Inhibit Angiogenesis and Tumor Growth. Molecular Biology Reports, 39, 1493-1501. https://doi.org/10.1007/s11033-011-0887-y
- 9. Presta, M., Dell’Era, P., Mitola, S., et al. (2005) Fibroblast Growth Factor/Fibroblast Growth Factor Receptor System in Angiogenesis. Cytokine & Growth Factor Reviews, 16, 159-178. https://doi.org/10.1016/j.cytogfr.2005.01.004
- 10. Pai, R., Szabo, I.L., Kawanaka, H., et al. (2000) Indomethacin Inhibits Endothelial Cell Proliferation by Suppressing Cell Cycle Proteins and PRB Phosphorylation: A Key to Its Antiangiogenic Action? Molecular Cell Biology Research Communications, 4, 111-116.
- 11. Dutour, A., Rabinovich-Chable, H., Kaletta, C., et al. (2004) Is Troponin I Gene Therapy Effective for Osteosarcoma Treatment? Study on a Human-Like Orthotopic Rat Model. Anticancer Research, 24, 3977-3972.
- 12. Barbara Fingleton (2008) MMPs as Therapeutic Targets—Still a Viable Option? Seminars in Cell & Developmental Biology, 19, 61-68.
- 13. Li, Q., Shen, P.Y., Wu, G., et al. (2003) Polycystin-2 Interacts with Troponin I, an Angiogenesis Inhibitor. Biochemistry, 42, 450-457. https://doi.org/10.1021/bi0267792
- 14. Fukumoto, S., Sakaguchi, T., You, M., et al. (2006) Tick Troponin I-Like Molecule Is a Potent Inhibitor for Angiogenesis. Microvascular Research, 71, 218-221.
- 15. Ara, M.N., Hyodo, M., Ohga, N., et al. (2014) Identification and Expression of Troponin T, a New Marker on the Surface of Cultured Tumor Endothelial Cells by Aptamer Ligand. Cancer Medicine, 3, 825-834. https://doi.org/10.1002/cam4.260
- 16. Chen, C., Liu, J.-B., Bian, Z.-P., et al. (2014) Cardiac Troponin I Is Abnormally Expressed in Non-Small Cell Lung Cancer Tissues and Human Cancer Cells. International Journal of Clinical and Experimental Pathology, 7, 1314-1324.
NOTES
*通讯作者。
