World Journal of Forestry
Vol.3 No.03(2014), Article ID:13866,12 pages
DOI:10.12677/WJF.2014.33009
The Enzymolysis in the Enzymatic Degradation of Eucommia ulmoides Leaves to Gain Gutta Percha Filament [Part I]
—Enzymolysis of Cuticle Layer in Eucommia Leaves
Guizhou Province Key Laboratory of Fermentation Engineering & Biological Pharmacy, Guizhou University, Guiyang
Email: *xzhang203@aliyun.com
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



Received: Jul. 7th, 2014; revised: Jul. 20th, 2014; accepted: Jul. 25th, 2014
ABSTRACT
Eucommia ulmoides is a kind of natural rubber resources whose potential application is greater than Hevea. But the difficulty of extracting gutta percha restricts the application and development of gutta percha. Instead of traditional treatment process using chemical, microbial, mechanical processing techniques, utilization of enzyme can control the pollution during the extraction from the “governance at the end” to “prevention from source”. At the same time, various natural products can be obtained when treated by enzyme method, which can reduce the production cost and improve economic benefits. More importantly, the enzyme method can obtain the original ecological natural gutta percha. Furthermore, the application fields of gutta percha and industrial value are increased. In this paper, the solution mechanism of enzyme and the organizational structure of Eucommia ulmoides leaves were studied with the recycled Eucommia ulmoides leaves used as raw material, and the production and application were discussed.
Keywords:Eucommia ulmoides, Biological Enzyme, Leaf Structure, Cutinase, Enzymolysis of Eucommia ulmoides Leaves, Gutta Percha

长丝杜仲胶的生物酶提取酶解作用[I]
——杜仲叶角质层的酶解
张学俊*,张效宁,张萌萌
贵州省发酵工程与生物制药重点实验室,贵州大学,贵阳
Email: *xzhang203@aliyun.com
收稿日期:2014年7月7日;修回日期:2014年7月20日;录用日期:2014年7月25日

摘 要
杜仲树是应用潜力比三叶橡胶树还大的优质天然橡胶资源。但是杜仲胶的提取难度制约了杜仲胶的应用和发展。利用酶处理工艺替代传统的化学、微生物、机械处理工艺,则能实现提胶生产污染防治由“末端治理”向“源头预防"的转变。且酶处理方法的多种天然产物的同时提取,显著降低了生产成本,提高产品经济效益。更主要的是酶法可获得原生态的天然杜仲胶,提高了杜仲胶的应用领域和工业价值。本文以可以再生的杜仲叶为原料,对杜仲叶的组织结构和酶解机理进行了研究,以及在生产的应用的研究进行了讨论。
关键词
杜仲,生物酶,叶片的结构,角质酶,杜仲叶的酶解,杜仲胶

1. 引言
杜仲树是世界上适应范围最广,应用潜力最大的优质胶源树种。在树干皮中、树叶中、以及杜仲翅果果皮中都含有丰富的、大量的杜仲胶。在杜仲植株的六大器官中均有含胶细胞,只是各部分的分布密度不同,叶片中的分布量为干重的3%~5%,成熟果实中为l0%~l8%,茎干皮中为6%~l2%,根皮中为10%~12%,而种壳中为l2%~18%。
杜仲(Eucommia ulmoides Oliv.)被子植物门杜仲科(Eucommiaceae),杜仲属,为地质史上第三纪冰川运动残留下来的古生物树种。杜仲适合我国集中连片种植,在我国的适生范围广,从平原到海拔1690米间的丘陵和山地均有栽培,具有广泛的适应性,在我国温带地区引种后,生长发育普遍良好。据统计我国种植杜仲面积占全世界的96%。杜仲野生的分布中心是在中国中部、西部地区,在我国有着丰富的杜仲资源。同时,由于杜仲胶的特殊的性质,作为天然生物材料,各国都在争相开展对杜仲胶的研究,日本,俄罗斯,朝鲜,缅甸北欧,北美等国家和地区也相继对杜仲胶进行引种种植。
在我国每种植1亩杜仲,杜仲籽和杜仲叶可为种植者创造纯收入2500元以上。生产60万吨杜仲胶则相应地需种植2000万亩的杜仲原料林,杜仲胶和杜仲药物的获取将形成3000亿元以上的杜仲大产业链,由此带动2000万种植杜仲的农民人均增加2500元以上的收入。同时,大力发展杜仲天然胶产业,可缓解我国天然橡胶需求紧缺的局面,对促进我国由世界第一天然橡胶消费大国变为世界橡胶工业强国意义重大。尽管发展杜仲产业的时是以杜仲胶为龙头,但是另一巨大的杜仲药物天然资源,既可以作为药物,更重要的是它们也是可再生的芳香化合物工业原料,这是石油、煤等矿物资源不可替代再生生物资源。
原生态的杜仲胶具有巨大的分子量和稳定的分子量分布,因为分子量大的杜仲胶分子间不易滑动,形成的分子间物理交联点多,抗张强度、抗冲击韧性显著提高,此外,分散性低的原生态杜仲胶聚合物,由于分子量分布窄,物理机械性、模塑、成膜和纺丝性能稳定,产品质量好、易控制。
2. 杜仲胶的生物酶提取
利用酶处理工艺替代传统的化学、微生物、机械处理工艺,实现杜仲胶提取工业污染防治由“末端治理”向“源头预防"的转变。工业提取工艺的一开始就采用无污染的生物酶提取工艺,从根本上防止污染,从源头上控制污染,真正达到零污染的目的。
酶法提取杜仲植物中的天然杜仲胶和杜仲药物具有其他方法不可达到的突出优点,主要为:
(1) 酶水解反应具有专一性,不破坏杜仲胶和杜仲天然药物成分的化学结构和物理性状;
(2) 酶解反应条件温和,温度在~50℃,pH为弱酸弱碱,保持了杜仲胶和药物成分活性和功能;
(3) 有效破坏植物组织结构和细胞,胞内和胞外的天然成分全部溶于酶解液,达到高效率提取;
(4) 原料不粉碎,杜仲胶保持原生状态,且分子量分布范围窄,保持原有的结构,物理化学性质稳定。
杜仲胶的独特性能所赋予它的重要战略地位,而高品质杜仲胶的提取在杜仲胶的应用产业链中处于核心地位,是杜仲胶应用工业可持续发展的物质基础。国内外杜仲胶的产品应用已覆盖到多个领域。作为低温热可塑材料,应用范围包括高尔夫球、医用代石膏骨科外固定及矫形用杜仲胶夹板、运动员护支具、假肢支撑腔(假肢套)、牙齿填料、运动员护齿等。作为热弹性形状记忆材料,由于其独特的形状记忆功能,可用于实验室玻璃仪器接管、真空油泵、真空水泵密封接管等。由于其优异的耐磨性和抗撕裂强度,与顺丁二烯橡胶等合成橡胶共混制成综合性能优异的高性能轮胎。更重要的应用则在:海底电缆、飞机遥测遥感雷达天线透雷达波用密封薄膜、塑料改性、沥青改性、高拉伸疲劳帘子布胶改性、气密性橡胶组合物、减震降噪集成材料(可用于潜艇)以及其他特殊环境下使用的新型功能材料等,以及在军事工业、航母、潜艇、和航空、航天业填补空白的应用。
而这些应用都是以高品质的原生态长丝杜仲胶为基础,也就是不同聚合度的、且分子量分布均匀的杜仲胶具有的不同的、突出的物理、化学性质,才能适用于不同的领域和不同的用途,显示出全新的新材料性能。分子量或者聚合度对高聚物材料的力学性能以及加工性能有重要影响,聚合物的分子量或聚合度只有达到一定数值后,才能显示出适用的机械强度,这一数值称为临界聚合度。显然,低于这一临界值后,提取的杜仲胶也就失去了使用价值,失去了工业生产的意义。而就目前的杜仲胶提取技术而言,只有生物酶法技术能够获得不低于这一临界值的杜仲胶。
3. 功能生物酶的选用
酶工程是生物技术的一个重要组成部分,在特定的生物反应器内利用酶的催化作用进行物质转化,植物组织在转化过程中被水解成聚合物的单体分子,如组成纤维素、果胶、半纤维素的单糖,组成蛋白质的氨基酸,组成角质层的脂肪酸等等。酶催化反应可以使多官能团底物在无保护的条件下进行温和环境友好的转化,并具有高度的选择性、对底物的专一性、和对映选择性等。
杜仲是一种十分古老的树种,距今约200万年前第四纪冰川的侵袭,致使欧洲、亚洲、及北美洲大陆的杜仲科植物灭绝,而我国中、西部的复杂的地形地貌在一定程度上阻挡了冰川,杜仲科中的一个种类有幸存活下来,成了我国特有的植物物种。杜仲被科学家称为“先锋植物”,有着极其顽强的生命力。在200多万年的进化中,使杜仲树的生长适应性和抗微生物侵蚀的能力增强。正是由于杜仲植物具有极强的生命力和抗微生物侵蚀的能力,很难发现生长在杜仲植物上的微生物,和腐烂、患微生物病害的组织,也就无法从杜仲植物的病害组织中分离、纯化相关的、针对性强的微生物,从中获得底物准确的生物酶。酶法破坏杜仲植物组织除了研发新型功能酶外,主要途径是购买各种酶产品和制剂,从中筛选出能有效破坏杜仲植物组织的生物酶。
4. 杜仲植物组织的复杂性
各种可供选择的同工功能酶的种类很多,但是,对杜仲植物进行酶水解除去植物组织结构中,却没有从侵蚀杜仲植物组织的微生物中分离出来的、高度针对性功能酶,显然,用其他微生物酶降解杜仲植物组织的关键则集中在酶解底物,复杂的杜仲植物组织的结构上,及酶的功能和底物杜仲组织的一致上。
常用的杜仲原料组织结构主要有三种:杜仲叶、杜仲翅果皮和杜仲树干皮。
杜仲叶
在杜仲植物表面,特别是杜仲叶和翅果皮表面有一酯类聚合物薄膜——角质层,是抵御病菌和细菌侵染的屏障,也抵御了纤维素酶、果胶酶、蛋白酶、葡聚糖酶、脂肪酶等对杜仲组织的降解。酶解法提取杜仲胶和天然药物成分,必须先将这一层角质层去除。角质酶具有水解植物叶片表面角质层的功能。
杜仲植物的组织结构非常复杂,植物由许多来源相同、形态结构相似、机能相同而又紧密联系的细胞所形成的细胞群,称为组织。常根据功能和结构的不同,分为两大类:分生组织和成熟组织。
杜仲叶中含有类似于杜仲皮中的天然药物,以及大量的杜仲胶,而这些杜仲胶并不是均匀分布在整个叶片中,只存在于叶脉中,图1中红色部分是杜仲叶的叶脉。图2是轻轻掰开的杜仲叶,胶丝从叶脉的断口处暴露出来。图中显见,杜仲叶中的杜仲胶陈现为稀疏的网状结构,叶脉越粗,所暴露出的胶丝越粗,为多股胶丝,叶脉越细则胶丝也越细,为单根胶丝。这一现象与杜仲植物组织中杜仲胶合成酶及含胶细胞的分布有关。由此可见,叶片中含胶细胞的分布是不均匀的,主要集中在于叶片的叶脉中。
叶脉中杜仲胶的积累与杜仲叶的光合作用有关,图3显示二氧化碳经光合作用后生成的类异戊二烯
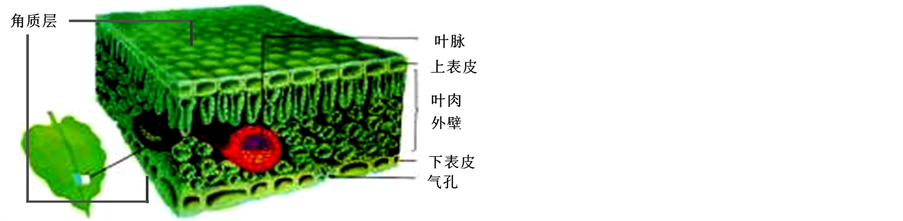
Figure 1. Organization of the blade profile
图1. 叶片的剖面组织结构图

Figure 2. Distribution of Eucommia ulmoides leaf veins and gutta percha filaments. The cruder the veins, the thicker the rubber wire and vice versa
图2. 杜仲叶的叶脉与杜仲胶丝的分布。叶脉越粗胶丝也越粗,叶脉越细则胶丝越细

Figure 3. Photosynthesis and the path of the leaf
图3. 叶的光合作用及路径
在叶脉维管中经酶的作用形成高聚合度的杜仲胶的过程。光合作用首先发生在叶绿体的囊状结构薄膜上,叶绿体色素吸收光能将水分子分解成氧和氢,氧分子被释放,氢则传到基质作为还原剂参与到第二个阶段的化学反应中,在相关酶作用下,氢使ADP与Pi反应形成ATP,以化学能形式储存于ATP。光合作用第二个阶段是暗反应,在叶绿体基质中进行,没有光参与,ATP为化学反应提供能量。绿叶吸收的二氧化碳先与植物体内的五碳原子的化合物(C5)结合而固定下来,再经酶作用生成三碳原子和二碳原子化合物(C3, C2),在酶的作用下这些化合物接受ATP能量被氢还原,再经过一系列的代谢过程形成不同有机物,特别是有部分生成类异戊二烯和萜类化合物。
类异戊二烯是植物界广泛存在的一类天然烃类化合物,通式为(C5H8)n。根据所含异戊二烯的数目,萜类可分为单萜(C10)、倍半萜(C15)、双萜(C20)、三萜(C30)、四萜(C40)和多萜(C>40)等,是自然界分布广泛、种类最多的一类植物天然产物。植物类异戊二烯的生物合成存在两条生物合成途径。一条是甲羟戊酸途径,这是我们关心的,因为杜仲胶的合成都是通过这一途径,并有甾体类、倍半萜生成。在细胞质中,由乙酰辅酶A出发,3个乙酰辅酶A缩合生成β-羟基,β甲基戊二酰辅酶A(HMG-CoA),乙酰辅酶A硫解酶(AACT)和HMG-CoA合成酶(HMGS) 合作完成了这一代谢过程,在HMG-CoA还原酶(HMGR)的作用下生成甲羟戊酸(MVA),再经焦磷酸化和脱羧作用形成C5的异戊烯基焦磷酸IPP。由于甲羟戊酸的形成是一个不可逆过程,HMGR就成了这一途径上的反应速度限制酶[1] 。第二条途径是丙酮酸/磷酸甘油醛途径,又称为非依赖甲羟戊酸途径,在植物特有的细胞器—质体中进行,单萜和二萜等通过这种方式得到[2] 。这两个途径的主要区别是异戊烯基焦磷酸(IPP)的形成机制的不同,丙酮酸/磷酸甘油醛途径中IPP的直接前体不是甲羟戊酸。
天然杜仲胶的生物合成是一种典型的植物类异戊二烯的次生代谢途径产物。
植物类异戊二烯化合物具有不同的功能。萜类中相对量较大的精油、树脂、蜡等都是重要的再生资源,如溶剂、调味品、香料、粘合剂等(Dawson F.A., 1994)。以及工业上急需的多聚物,三叶橡胶树的橡胶、杜仲树的杜仲胶等天然产物,都是类异戊二烯产品。
叶脉就是生长在叶片上的维管束,它们是茎中维管束的分枝,叶脉中含有机械组织支持叶片,是叶片的“骨架”。叶脉中有输送水分和无机盐的导管和输送光合作用生成有机产物的筛管。当类异戊二烯等物质通过筛管进入到韧皮部中含杜仲胶合成酶的细胞中(图4),则聚合成杜仲胶,并随着植物的生长和类异戊二烯化合物的积累,含胶细胞中的胶丝分子逐渐增大,形成高分子量的天然聚合物。这些含胶细

Figure 4. Cross section of the leaf vein, Eucommia ulmoides gum cells exist in the phloem
图4. 树叶的叶脉横截面,杜仲胶细胞存在于韧皮部
胞都集中的叶脉的维管的形成层中。
叶脉是生长在叶片上的维管束,是茎中维管束的分枝。维管束组织经过叶柄分布到叶片的各个部份,有时也包括其周围连接着的基本组织(薄壁或厚壁、厚角组织)。叶脉由不含叶绿素的薄壁组织、厚角细胞等支持组织包围维管束所形成的沿叶背轴侧凸出的肋条。比较粗大的叶脉称为主脉(major vein),比较细小的叶脉称为细脉(minor vein),细脉全体交错分布,将叶片分为无数小块,形成叶片内的运输通道。任何植物到一定程度以下的细脉则不形成维管束鞘。网状脉与叶肉有明显区别。维管束一般为维管束鞘所包围,在叶肉内海绵组织的上层分化,不直接与细胞间隙通连。主脉是叶片的骨架,起到主干的输导与支撑作用,含有两种管道:导管和筛管。导管输送水分和无机盐,筛管输送有机产物。导管主要在茎部的木质部,输导无机盐和水,从下到上;筛管主要在韧皮部,输导有机物,如萜类、糖类化合物,从上到下。筛管分子的旁侧有一个以上的狭长伴胞,有些植物的叶脉中的伴胞发育为传递细胞,使筛管分子与伴胞更加紧密的联系。同时,由于它们位于筛管分子与叶肉之间,能更高效的传递光合产物。
形成层是分生组织,有很多细胞进行分裂,补充木质部以及韧皮部的细胞,所以树木会长粗。
叶脉与树茎的情况类似,在树干中,形成层分维管形成层和木栓形成层。位于木质部和韧皮部之间的一种分生组织(图5)。经形成层细胞的分裂,可以不断产生新的木质部与韧皮部,使茎或根不断加粗,形成层的细胞特征可分为两种类型:纺锤状原始细胞和射线原始细胞。木本植物之所以粗壮高大,就是因为有形成层;而草本植物矮小,就是因为没有形成层。木栓形成层主要指周皮,由于形成层的活动,木本植物的茎可以逐年增粗。木质部与水分和无机盐的输导有关,韧皮部与有机物的运输有关。
5. 杜仲叶表面角质的酶解
角质层是植物防止机械损伤和微生物侵蚀的保护层,主要由角质(cutin)和角质层表面的蜡(wax)两类化合物组成。
角质是高等植物表层的一种生物聚酯,其单体主要由十六碳、十八碳的羟基脂肪酸和环氧脂肪酸组成(Nawrath, 2006)。典型的聚合体结构如图6所示[3] 。
继Von Moh L提出角质层的结构模型后,其他研究人员也提出了多种与此类似模型,如有的模型认为角质层的由外到里分别是蜡、初生角质层、次生角质层共同构成角质层。角质层的下方与属于细胞壁的亚角质层相邻。角质层中的蜡除了表面蜡以外,还有角质层内部蜡,两者的化学组成略有差异。这些模型的提出为植物角质层的研究提供了理论基础。

Figure 5. Gutta percha growth in the vein and trunk vascular phloem parts
图5. 杜仲胶生长在叶脉和树干皮的维管韧皮部位

Figure 6. The typical structure of the cutin polymer
图6. 角质聚合体的典型结构
植物学上人们对植物角质层的研究已有大约160年的时间,对角质层的生化特性工作及其结构与功能做了深入的探讨。角质是角质层的主要成分之一,主要作用是控制植物与环境的水分交换,调节植物体温,防止机械损伤和抵御病菌侵害。角质层不仅仅是污染物质进入植物体的通道,而且也可能是这类污物积累的场所。在角质层的断裂处,常常易于发生病菌对植物的侵染,这一事实表明角质层对病菌,或者细菌分泌的生物酶的侵染的确是一道重要的屏障。苹果、番茄、黄瓜等的角质层是其抵御物理、化学、生物因子包括致病菌侵袭的屏障。
近年来,利用酶工程法提取杜仲叶中天然成分的报道大多采用的是纤维素酶和果胶酶。但原料必须粉碎,因为杜仲叶的表面有一层角质保护层,它阻挡了纤维素酶和果胶酶对叶片组织的降解。药厂的提取工艺中药材一般都不粉碎,只切片。显然,未经粉碎原料叶片进行酶降解提取,就必须先降解表面的角质层才可能有效地进行酶提取,而这一研究在国内还未见有报道。
植物的细胞壁是由纤维素组成的,细胞之间由果胶粘接。如图7所示。本文采用酶解法将杜仲叶角质层从叶片上分离,利用纤维素酶与果胶酶酶解部分植物细胞壁及与角质层黏连的果胶质,从而使得杜仲叶角质层完整的分离下来。
6. 杜仲叶角质层的观察
将杜仲叶置于50℃烘箱中烘干至恒重,挑选厚度均一的杜仲叶,用打孔器将杜仲叶片打成直径为1 cm的圆片,打圆片时应尽量避开杜仲叶的一级叶脉。将杜仲叶去色,制作切片,用苏丹Ⅲ染色后,在400倍显微镜下观察角质层。苏丹Ⅲ是弱酸性染料,脂肪与苏丹染液有比较强的亲和力,呈红色粉末状,易溶于脂肪和酒精,是脂肪染色剂,见图8和图9。

Figure 7. Cuticle on the leaf surface of plants
图7. 植物叶表面角质层示意图


Figure 8. Sultan III staining sections under a 400 times microscope
图8. 苏丹III染色后在400倍显微镜下观察切片

Figure 9. Sultan III staining Eucommia ulmoides leaves after soaked, a is staining cuticle, b is midrib vascular, c is parenchyma cells, d is scattered gutta containing cell
图9. 浸泡后的杜仲叶的苏丹III染色,a为染色角质层、b为中脉的维管、c薄壁组织细胞、d散生含胶细胞
分别将杜仲叶用水、已腈浸泡后切片再用苏丹III染色,在高倍显微镜下观察结果如图9。
从图8中可明显观察到被染色后的角质层。图9中A为水浸泡5天后后切片染色;B为用已腈浸泡5天后切片并染色;C杜仲叶脉切面。通过显微镜发现,杜仲叶上表皮是一层排列紧密的细胞,外被角质层,厚度约2~7 μm,气孔器较多,气孔分布密度约为100 μm2中7~9个下表皮细胞,细胞外被角质层向外拱起。
7. 杜仲叶的角质层
用打孔器将杜仲叶片打成直径为1 cm的圆片,在低温(50℃)下烘干至恒重,备用。
称取杜仲叶圆片1 g,分别加入pH 4.0的果胶酶液与pH 5.5的纤维素酶单独作用1 d,可得图10。
图10中可看出,直接用果胶酶和纤维素酶水解杜仲叶,杜仲叶表皮的组织结构(角质层及其他杂质)都不能被破坏,杜仲叶基本上保持了其原来的状态。因此单靠果胶酶与纤维素酶是无法完全实现的全酶法水解的。
先将杜仲叶用pH 5.5的果胶酶液(将果胶酶按2%的w/v溶于pH为5.5的配置好的柠檬酸–柠檬酸钠缓冲溶液中,待酶溶解到溶液中,静置后取上清液。)处理4天后,换用pH5.5的复合酶液(将pH 3.0的纤维素酶和pH 5.5的果胶酶按2%的w/v溶于pH 5.5的柠檬酸–柠檬酸钠缓冲溶液,配置为复合酶液。)处理3天,可得图11。
图11显示,通过以上酶的处理,可以使杜仲角质层脱落,图中可看到杜仲叶圆片上有鼓起的小泡,随着小泡的扩散角质层可完全脱落。角质酶液的制备:将棉花枯萎病菌及胶红酵母菌接种到相应的最适发酵产酶的基础培养基中,分别培养6 d和5 d,离心,过滤,得粗酶液备用。再按比例配置0.1 M柠檬酸–柠檬酸钠缓冲溶液进行角质酶解。将杜仲叶圆片与胶红酵母产的角质酶粗酶液反应3d后,再换用pH为4.0的果胶酶及pH为5.5纤维素酶液处理2d,得图12。

Figure 10. Eucommia ulmoides leaves treated by pectinase and cellulase
图10. 果胶酶、纤维素酶处理后的杜仲叶

Figure 11. Cuticle shedding away from Eucommia ulmoides leaf surface treated by pectinase, showed with arrow
图11. 经果胶酶处理后,从杜仲叶表面脱落离的角质层,箭头处
图12可看出,杜仲叶经角质酶粗酶液作用后再用果胶酶和纤维素酶作用,杜仲叶表面的角质层分解,显示胶红酵母发酵所得的角质酶液对杜仲角质层有较好的水解除去作用。
与之对照的杜仲叶圆片用1%的NaOH溶液反应3d后,再换用pH为4.0的果胶酶及pH为5.5纤维素酶液处理2d,可得图13。
从图中可看出,1%的NaOH溶液处理后再经再用果胶酶和纤维素酶作用的杜仲叶并无明显的变化,与图12对比可发现,角质酶粗酶液对杜仲叶角质层的水解作用比1%的NaOH效果显著。
将杜仲叶圆片用蒸馏水浸泡3 d后,再换用最适pH为4.0的果胶酶及最适pH为5.5纤维素酶液处理2d后得图14。


Figure 12. Cutinase + pectinase, cellulase
图12. 角质酶 + 果胶酶、纤维素酶

Figure 13. Eucommia ulmoides leaves treated by NaOH + pectinase, cellulase
图13. NaOH + 果胶酶、纤维素酶处理的杜仲叶

Figure 14. Eucommia ulmoides leaves treated by water + pectinase, cellulase
图14. 水 + 果胶酶、纤维素酶处理的杜仲叶
通过对比图12-14可以看出,先将杜仲叶用角质酶液作用后再用果胶酶和纤维素酶作用的这组杜仲叶的边缘部分已经发生了降解,说明杜仲叶表面的角质层被角质酶粗酶液水解掉。而另外两组用蒸馏水和NaOH作用的却无明显作用。
从实验中发现在相同的处理时间内,低浓度的氢氧化钠效果并无角质酶液作用效果显著,因此我们实验室选择先用角质酶液与杜仲叶作用,再用果胶酶、纤维素酶、半纤维素酶与被角质酶液作用过的杜仲叶作用,证明了胶红酵母产角质酶液对杜仲中天然产物成分提取的作用。
8. 角质酶液与杜仲叶的反应
角质酶液是否能与杜仲叶反应,将胶红酵母接种到最适合产酶的基础培养基中,发酵培养后,离心,过滤,将粗酶液收集备用。
杜仲叶在处理以前,为整张的叶片,特别是成熟的杜仲叶,显得较硬,不柔软,见图15。
加入角质酶粗酶液,进行酶解作用,在40℃条件下酶解3d后,见图16[4] [5] 。
图16所示,角质酶粗酶液酶解后的杜仲叶变得柔软,坚挺的叶片已开始呈腐烂状,但是其中还存在许多没有被完全破坏的叶片。这时由于酶解作用,一部分叶的组织已经变成小分子溶解在酶解液中,使酶解溶液的体积增大,而叶片的残余固体组织减少,需要进一步的酶解作用。

Figure 15. Eucommia ulmoides leaves without the treatment
图15. 处理前的杜仲叶

Figure 16. Eucommia ulmoides leaves treated with cutinase liquid
图16. 经角质酶液进行处理后的杜仲叶
将上述处理过的杜仲叶与pH 4.0的果胶酶液在55℃下酶解2 d,得到图17。
经过果胶酶的继续酶解反应后,果胶酶对其降解的组织破坏后,使大部分的叶片组织溶解在酶解液中,残余的固体组织进一步减少,可以看到杜仲胶丝已经被游离出来。针对角质酶液和果胶酶液降解的杜仲叶组织结构的化学成分,进一步地采用纤维素酶和半纤维素酶对残余的固体组织部分继续进行酶解反应,反应约1 d后,得图18。
图18显示,经过四种酶逐次降解破坏后,杜仲叶已成了稀泥,除了由于叶柄中含有木质素难以降解而残留下来外,其余的部分几乎全部分解而被酶解溶液带走。图中泥浆丝的黄色部分便是从杜仲叶片游离出来的杜仲胶丝。杆状的残余物是杜仲叶柄。这时它们已是没有表皮的树皮部分,含有杜仲胶丝的表皮也在酶解过程中溶解、分散在反应液中。
这说明由于全生物酶酶解法无需粉碎杜仲叶原料,也就保护了活性物质(杜仲胶、杜仲药物等)原来的结构,从而也就使之保存了其原有的物理性质。显然可以想象,如果先将杜仲叶片粉碎,是不可能得到缠绕在一起的长丝杜仲胶,其高分子特性的聚合度也会严重下降,从而影响到杜仲胶的应用范围。角质酶的加入取代了低浓度NaOH溶液,其作用结果比低浓度的NaOH更加理想。因此,可将角质酶用于大规模生产,从而推广到植物中天然成分的提取过程[6] (图19)。

Figure 17. The residual part of Eucommia ulmoides leaves after pectinase degradation
图17. 果胶酶降解杜仲叶片后的残余部分

Figure 18. Treated by four kinds of enzyme of Eucommia ulmoides leaf residue glue
图18. 经过四种酶处理后的杜仲果叶片残渣杜仲胶

Figure 19. Infrared absorption of gutta percha filament
图19. 杜仲胶丝红外吸收图[7]
9. 小结
与低浓度NaOH的对比验证了胶红酵母菌发酵产生的角质酶液对杜仲角质层的作用是显著的。低浓度的NaOH有可能使杜仲叶中所含的部分天然药物发生降解,这对天然药物的提取是不利的。此外,NaOH还存在着对环境污染的影响,而且其对杜仲叶的水解作用也没有角质酶液效果明显,因此采用胶红酵母发酵产角质酶的粗酶液与杜仲叶反应除去角质层的应用前景更广阔,也对角质酶液运用到杜仲中活性成分的提取具有十分重要的意义。
参考文献 (References)
- [1] Choi, D., Ward, B.L. and Bostock, R.M. (1992) Differential induction and suppression of potato 3-hydroxy-3-methylglutaryl coenzyme A reductase genes in response to Phytophthora infestans and to its elicitor arechidonic acid. Plant Cell, 4, 1333-1344.
- [2] 陈大华, 叶和春, 李国凤, 刘彦 (2000) 植物类异戊二烯代谢途径的分子生物学研究进展. 植物学报, 6, 551-558.
- [3] Holmquist, M. (2000) Alpha/Beta-hydrolase fold enzymes: Structures, functions and mechanisms. Current Protein & Peptide Science, 1, 209-235.
- [4] 张文坤 (2012) 真菌角质酶诱导表达的研究. 学位论文, 贵州大学, 贵阳.
- [5] 冉琴琴 (2014) 真菌产角质酶的研究及应用. 学位论文, 贵州大学, 贵阳.
- [6] 兰小艳 (2010) 杜仲叶中绿原酸的提取及酶处理研究. 硕士学位论文, 贵州大学, 贵阳.

NOTES
*通讯作者。