Advances in Marine Sciences
Vol.03 No.03(2016), Article ID:18628,8
pages
10.12677/AMS.2016.33014
Effects of Phosphate on the Growth and Cell Pigment Accumulation of Dunaliella salina
Xiaotian Liu, Peilei Wang
Life Department, Linyi University, Linyi Shandong

Received: Sep. 8th, 2016; accepted: Sep. 25th, 2016; published: Sep. 28th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The effects of KH2PO4 with different levels on the growth and cell pigment accumulation of Dunaliella salina were investigated and the results indicated that the maximum growth of 153 × 104 cell/mL was detected in culture medium with 0.1 mmol/L KH2PO4 and the minimum of 36 × 104 cell/mL in the control group. The culture medium with 0.20 mmol/L KH2PO4 had the highest β-carotene content of 12.8 mg/L, followed by 11.04 mg/L with 0.15 mmol/L KH2PO4, and the control group had lower β-carotene content of only 6.28 mg/L. Over 0.25 mmol/L KH2PO4 was found to have depressing function to cell growth. Right level KH2PO4 was helpful to chlorophyll a biosynthesis. During the first 6 days within culture period, pH values of the culture media rose up, and then declined in the following 4 - 5 days. The cells which were cultured in media with 0.10 mmol/L KH2PO4 had the highest protein content of 37.34%, while the control group only had 24.86%; 0.10 mmol/L KH2PO4 was assimilated completely within 6 days, and the uptake time had right-relationship with KH2PO4 contents. Finally, the assimilated mechanic equation of KH2PO4 by D. salina was set up.
Keywords:KH2PO4, Dunaliella salina, Growth, β-Carotene, Absorpted Patterns

磷酸盐对盐生杜氏藻生长 和细胞色素积累的影响
刘笑天,王培磊
临沂大学生命科学学院,山东 临沂

收稿日期:2016年9月8日;录用日期:2016年9月25日;发布日期:2016年9月28日

摘 要
研究了不同浓度(0~0.30 mmol/L)的KH2PO4对盐生杜氏藻生长和细胞色素积累的影响,结果表明,添加0.10 mmol/L KH2PO4,细胞生长最快,最高密度为153 × 104 cell/mL,无磷对照组密度最低,仅为36 × 104 cell/mL;KH2PO4浓度为0.20 mmol/L时,β-胡萝卜素积累量最高,为12.8 mg/L,其次是0.15 mmol/L,对照组很低,仅为6.28 mg/L,KH2PO4超过0.25 mmol/L对β-胡萝卜素积累有抑制作用;适当添加KH2PO4对D. salina叶绿素a合成有促进作用;在培养的前6天,pH值明显上升,随后4~5天又下降;添加0.1 mmol/L KH2PO4细胞蛋白质含量最高,为37.34%,对照组仅为24.86%;0.10 mmol/L组的KH2PO4在6天内吸收完毕,KH2PO4吸收的时间与其最初的浓度呈正相关关系,建立了藻液中KH2PO4被盐生杜氏藻吸收的动力学方程。
关键词 :KH2PO4,盐生杜氏藻,生长,β-胡萝卜素,吸收规律

1. 引言
β-胡萝卜素具有猝灭人体自由基、延缓衰老、抑制肿瘤转化及抗癌等生物活性功能 [1] ,因而受到广泛瞩目。盐生杜氏藻Dunaliella salina在一定培养条件下能大量积累β-胡萝卜素,最高可达细胞干重的14% [2] 。目前,澳大利亚、以色列、美国、中国、日本、西班牙、加拿大等国家已有几十家公司从事杜氏藻生产,杜氏藻产品的市场仍在日益扩大 [3] 。我国具有漫长的海岸线和星罗棋布的内陆盐湖,具有培养杜氏藻生产β-胡萝卜素得天独厚的自然条件。营养盐为影响杜氏藻生长和β-胡萝卜素积累的重要环境因子之一。明确杜氏藻对磷盐的吸收规律及杜氏藻生长阶段和β-胡萝卜素积累阶段对磷盐种类和浓度的不同要求对优化杜氏藻培养基配方、提高杜氏藻及β-胡萝卜素产量、降低养殖成本有重要的参考价值。
2. 材料与方法
2.1. 藻种
盐生杜氏藻北京1号(Dunaliella salina Beijing 1),由内蒙古兰太集团生物公司提供。
2.2. 培养条件
2.2.1. 卤水
饱和卤水取自内蒙古兰太盐湖,盐度356,比重1.09,pH 6.03。用蒸馏水稀释至盐度120。
2.2.2. 营养盐
一次性添加NH4NO3 0.4 mmol/L,尿素0.20 mmol/L,柠檬酸铁0.01 mmol/L,NaHCO33.0 mmol/L,KH2PO4添加量为0.10,0.15,0.20,0.25,0.30 mmol/L,并设无磷组为对照。
2.2.3. 温度
空调控温,25℃± 1℃。
2.2.4. 光照
日光灯管照明,光强3200 lux,光/暗周期为16 h/8 h。
2.2.5. 其它
250 mL三角烧瓶,取对数生长期藻种接种,接种密度2.0 × 104 cell/mL。每天摇瓶6次,实验设三个平行样,重复两次。
2.3. 测定指标和测定方法
2.3.1. 细胞计数
血球计数板法计数,每天一次。
2.3.2. β-胡萝卜素的测定 [4]
培养至12天时测定。
5 mL藻液(加入少量碳酸镁)→90%丙酮萃取→上清液→90%丙酮定容至50 mL→721分光光度计测OD450值
β-胡萝卜素含量(mg/L) = (定容体积 ´ 10 ´ OD450) ´ 1000 ÷ (2500 ´ 取样体积)
式中体积单位均为毫升(mL),测定叶绿素a时同。
2.3.3. 叶绿素a的测定 [4]
培养至7天时测定。
5 mL藻液(加入少量碳酸镁)→90%丙酮萃取→上清液→90%丙酮定容至50 mL→721分光光度计测OD663、OD645值。
叶绿素含量(mg/L) = (8.02 ´ OD663 +20.21 ´ OD645) ´ 定容体积 ÷ 取样体积
2.3.4. pH值
用Orion Model 828型酸度计测定,每天一次。
2.3.5. 蛋白质测定
培养至12天时,取藻液500 mL,离心,蒸馏水冲洗藻泥,再离心,重复3次,冷冻干燥。取干藻粉0.1~0.2 g,凯氏定氮法测定蛋白质含量。
2.3.6. 脂肪酸测定 [4]
取冷冻干燥的样品0.1 g,经皂化、甲酯化,萃取,气相色谱仪(HP-5890型)测定脂肪酸组分。按峰面积归一化法计算脂肪酸组分百分含量。
2.3.7. KH2PO4浓度测定 [4]
取藻液5 mL,离心,取上清液,按Murphy和Riley所提供的方法测培养液中残存的KH2PO4的浓度,每天一次。
2.4. 数据处理
采用SPSS软件包对结果进行统计分析,以0.05作为差异显著性水平。
3. 结果
3.1. KH2PO4对D. salina细胞生长的影响
KH2PO4对D. salina细胞生长的影响见图1。从图1可见,添加0.10 mmol/L KH2PO4藻液中的细胞生长最快,最高密度为153 × 104 cell/mL,而KH2PO4浓度超过0.20 mmol/L对细胞的生长和分裂有抑制作用。无磷对照组的细胞密度最低,仅为36 × 104 cell/mL (p < 0.05),说明适当添加KH2PO4对D. salina生长有促进作用。
3.2. KH2PO4对D. salina β-胡萝卜素积累的影响
KH2PO4对D. salina β-胡萝卜素积累的影响见图2。从图2可以看出,β-胡萝卜素积累最适宜的KH2PO4浓度是0.20 mmol/L,藻液β-胡萝卜素最大值为12.8 mg/L,KH2PO4超过2.50 mmol/L对β-胡萝卜素的合成有抑制作用。无磷对照组的β-胡萝卜素含量较低,仅为6.28 mg/L (p < 0.05)。可见适量添加KH2PO4可以促进β-胡萝卜素的合成。

Figure 1. Effect of KH2PO4 on the growth of D. salina
图1. KH2PO4对D. salina生长的影响

Figure 2. Effect of KH2PO4 on the biosynthesis of β-carotene in D. salina
图2. KH2PO4对D. salina β-胡萝卜素积累的影响
3.3. KH2PO4对D. salina叶绿素a合成的影响
KH2PO4对D. salina叶绿素a合成的影响见图3。从图3可见,浓度为0.25 mmol/L时,藻液中叶绿素a产量最高;而KH2PO4浓度为0.30 mmol/L的藻液的叶绿素a含量很低,说明太高的KH2PO4不利于叶绿素a的合成。值得注意的是,无磷对照组的叶绿素含量最低,说明适量KH2PO4对D. salina叶绿素a合成有促进作用。
3.4. KH2PO4对D. salina藻液pH值的影响
KH2PO4对D. salina藻液pH值的影响见图4。从图4可看出,在培养的前6天,pH值有一个明显上升趋势,随后4~5天在波动中下降。但无磷对照组pH值的变化不符合这个规律,pH值总体水平较低。
3.5. KH2PO4对D. salina细胞蛋白质含量的影响
KH2PO4对D. salina细胞蛋白质含量的影响见表1。表1显示,培养基中添加KH2PO4 0.1 mmol/L时,细胞中蛋白质含量最高,为37.34%;对照组蛋白含量最低,为24.86%,且处理组与对照组差异均显著(p < 0.05),说明在实验范围内,较低的KH2PO4有利于细胞内蛋白质的合成。
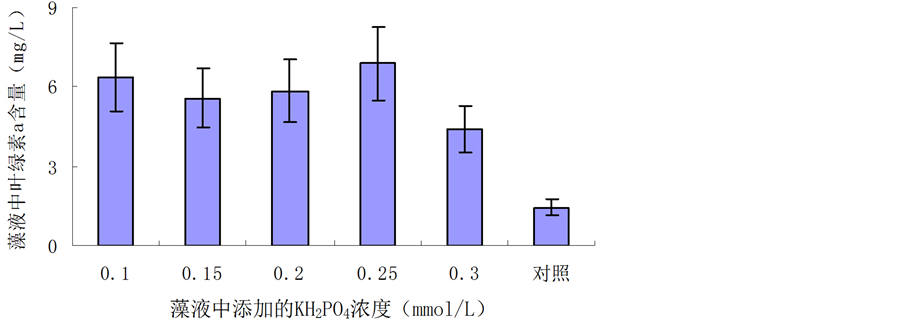
Figure 3. Effect of KH2PO4 on biosynthesis of chlorophyll a in D. salina
图3. KH2PO4对D. salina叶绿素a的影响

Figure 4. Effect of KH2PO4 on pH values of the D. salina media
图4. KH2PO4对D. salina藻液pH值的影响
3.6. KH2PO4对D. salina脂肪酸组成的影响
表2显示了KH2PO4对D. salina脂肪酸组成的影响,可见D. salina脂肪酸主要由16:0、18:1和18:2 ω-6组成,0.25 mmol/L组的总脂肪酸含量(82.60 ± 13.67%)是最高的,与对照组(70.26 ± 10.41%)有显著差异(p < 0.05)。
3.7. D. salina对KH2PO4的吸收规律
D. salina对KH2PO4的吸收规律见图5。从图5可见,最初溶液中KH2PO4的浓度越高,其残存时间越长,即KH2PO4在培养液中残存的时间与其最初的施用浓度呈正相关关系;最初5天磷的消耗较快,这是最初几天藻细胞生长、分裂迅速,光合作用旺盛的结果。
Table 1. Effect of KH2PO4 on the contents of cell protein in D. salina
表1. KH2PO4浓度对D. salina细胞蛋白质含量的影响
*表示与对照组差异显著(p < 0.05)。
Table 2. Effects of KH2PO4 on the fatty acid composition of D. salina
表2. KH2PO4对D. salina脂肪酸组成的影响(占总脂肪酸的百分比)
带*者表示与对照组差异显著(p < 0.05)。

Figure 5. Absorption patterns of KH2PO4 by D. salina
图5. 杜氏藻对KH2PO4吸收的情况
用数学模型拟合KH2PO4浓度为0.2 mmol/L藻液中KH2PO4的残存量和培养时间的关系,可得如下函数:

其中x为培养时间(天),y为藻液中残存的KH2PO4浓度(mmol/L)。
相关系数R2 = 0.9603,大于0.90,说明该方程较好地反映了D. salina对KH2PO4的吸收规律。
4. 讨论
N、P盐种类、浓度及其比例、温度、光照、盐度、pH值等对杜氏藻生长和β-胡萝卜素积累都有重要影响 [5] 。本研究表明,0.10 mmol/LKH2PO4有助于杜氏藻生长和β-胡萝卜素积累,但浓度超过0.20 mmol/L对细胞生长和β-胡萝卜素积累有抑制作用,且浓度越高,抑制作用越大。研究普遍认为,P、N饥饿或不足有利于β-胡萝卜素积累 [6] 。本研究结果也证实P的缺乏有助于单细胞β-胡萝卜素大量合成。笔者另一项研究表明,N缺乏不利于细胞生长,但有助于β-胡萝卜素积累,这与其他学者研究结果是一致的 [6] 。杜氏藻生长阶段和β-胡萝卜素积累阶段对光照、温度、营养盐、盐度等环境因子要求显著不同 [7] 。生长阶段要求高的营养盐浓度,而β-胡萝卜素积累阶段需要很低的营养盐浓度甚至是0。据此,Amotz et al. (1997)提出了杜氏藻生产的二阶段养殖法 [8] ,即先用较低的盐度和光照及较高的氮盐条件使藻增殖至较理想密度,再提高盐度和光照胁迫β-胡萝卜素积累。姜建国等研究表明,[N]/[P]比为15时,杜氏藻生长最好 [9] 。结合大生产的经验,我们认为培养基中添0.10 mmol/L KH2PO4对D. salina生长和β-胡萝卜素积累是较合适的。
培养过程的前6天,pH值有明显上升趋势,随后4~5天有一个下降。第4~6天是细胞分裂最旺盛的时间,这期间细胞的快速分裂、生长和旺盛的光合作用、大量消耗CO2正好与pH值的明显上升从时间上相吻合。不难推断,第1~6天pH值的上升是这期间细胞旺盛的分裂、生长和光合作用的结果。对于随后几天pH值的下降,Hirsch et al.认为,随着密度升高,细胞分泌一些酸性物质抑制细胞继续分裂,大量死亡的细胞也可能向藻液释放酸性物质,从而导致pH值下降 [10] 。本研究发现β-胡萝卜素大量积累的开始与pH值的下降在时间上是吻合的,由此推测β-胡萝卜素的合成是D. salina对细胞高度密集、分泌物大增、pH值上升等不良环境适应的结果。Amotz (1996)研究认为,pH值控制在8.0~8.5对杜氏藻生长和β-胡萝卜素积累比较合适 [11] 。pH升高不利于藻类继续生长和β-胡萝卜素的积累,生产上大多采用通入CO2的办法加以解决,既能降低pH值,又能补充碳源。
基金项目
国家863计划项目(863-
文章引用
刘笑天,王培磊. 磷酸盐对盐生杜氏藻生长和细胞色素积累的影响
Effects of Phosphate on the Growth and Cell Pigment Accumulation of Dunaliella salina[J]. 海洋科学前沿, 2016, 03(03): 100-107. http://dx.doi.org/10.12677/AMS.2016.33014
参考文献 (References)
- 1. 姜建国, 姚汝华. 氮磷比对盐藻生长及甘油和色素积累的影响[J]. 热带海洋, 1999, 18(1): 68-74.
- 2. 郝建欣, 孙玉, 丛威. 不同因子胁迫盐藻积累β-胡萝卜素异构体的HPLC动态规律分析[J]. 海洋科学, 2003, 27(2): 41-49.
- 3. Borowitzka, M.A., Borowitzka, L.J. and Kessly, D. (1990) Mass Culture of Dunaliella: from Laboratory to Pilot Plant. Journal of Applied Phycology, 2, 111-123.
- 4. 陈晗华, 钱凯先. 氮磷对盐藻生长及其β-胡萝卜素积累的影响[J]. 浙江大学学报, 1997, 31(6): 732-735.
- 5. Hejazi, M.A. and Wijffels, R.H. (1993) Cell Characteristics and Biochemical Composition of Dunaliella primolecta Butcher Conditioned at Different Concentration of Dissolved Nitrogen. Journal of Applied Phycology, 5, 447-453. http://dx.doi.org/10.1007/BF02182737
- 6. 李建宏, 翁永萍, 胡寒萍. 不同氮源对盐生杜氏藻生长和β-胡萝卜素积累的影响[J]. 南京师范大学学报, 1999, 22(3): 73-85.
- 7. Thakur, A. and Kumar, H.D. (1999) Effects of pH, Light Quality and Various Carbon Sources on Glycerol Production by the Brackish Water Alga Dunalia salina. Cytobios, 97, 79-83.
- 8. Laws, E.A. and Wong, D.C.L. (1978) Effect of Nitrate Concentration on Growth and Pigment Synthesis of Dunaliella salina Cultivated under Low Illumination and Preadapted to Different Salinities. Journal of Applied Phycology, 10, 406-411. http://dx.doi.org/10.1111/j.1529-8817.1978.tb02460.x
- 9. Giordano, M. and Bowes, G. (1997) A Salt-Induced Chloroplast Protein in Dunaliella salina (Chlorophyta). Plant Physiology, 115, 1049-1058.
- 10. Hirsch, R., Carandang, J. and Treffny, B. (1992) Effect of Low Temperature on the Stereoisomer Composition of β-Carotene in the Halotolerant Alga Dunaliella bardawil (Chlorophyta). Journal of Experimental Botany, 43, 887-894. http://dx.doi.org/10.1093/jxb/43.7.887
- 11. Amotz, A.B. (1996) New Mode of Dunaliella Biotechnology: Two-Phase Growth for β-Carotene Production. Phycologia, 32, 272-284.
