Open Journal of Nature Science
Vol.05 No.02(2017), Article ID:20581,11
pages
10.12677/OJNS.2017.52018
Metabonomics Analysis of Myocardial Injury Induced by Selenium Deficiency in Chicken
Wei Liu1,2, Haidong Yao1, Wenchao Zhao1, Meng Sun2, Shiwen Xu1*
1College of Veterinary Medicine, Northeast Agricultural University, Harbin Heilongjiang
2The Key Laboratory of Myocardial Ischemia, Ministry of Education, Harbin Medical University, Harbin Heilongjiang

Received: Apr. 28th, 2017; accepted: May 12th, 2017; published: May 22nd, 2017

ABSTRACT
Research purposes: Study on the changes of myocardial injury induced by selenium deficiency in chicken. Methods: 1-day old chicks with low selenium feed were chosen to build the chicken selenium deficient myocardial injury model. Plasma metabonomics analysis was applied to detect the differential metabolites. Results: There were 16 differential metabolites in selenium deficient plasma in positive and negative ion state. Among them, the abundance of choline, phosphatidyl glycerol and leucine were up-regulated (P < 0.01). Conclusion: Abnormal metabolism of glycerol and phospholipids, leucine, steroids and other biochemical substances were found in selenium deficiency group. These potential biomarkers are associated with inflammation, apoptosis, and platelet aggregation. It can provide new information for understanding the metabolic mechanism of selenium deficiency in chicken.
Keywords:Chicken Myocardial Cell, Selenium Deficiency, Metabonomics
鸡缺硒心肌损伤代谢组学分析
刘伟1,2,姚海东1,赵文超1,孙萌2,徐世文1*
1东北农业大学动物医学学院内科教研室,黑龙江 哈尔滨
2哈尔滨医科大学附属第二医院心肌缺血教育部重点实验室,黑龙江 哈尔滨

收稿日期:2017年4月28日;录用日期:2017年5月12日;发布日期:2017年5月22日

摘 要
目的:探讨缺硒致鸡心肌损伤的代谢组学变化。方法:选用1日龄雏鸡,采用低硒饲料喂养建立鸡缺硒心肌损伤模型;通过血浆代谢组学方法检测差异代谢物质。结果:发现正负离子状态下,缺硒组血浆均有显著差异代谢物质,共计16种。其中显著上调表达的有胆碱、磷脂酰甘油、和亮氨酸(P < 0.01)。结论:在缺硒组中观察到甘油、磷脂、亮氨酸、类固醇等生化物质的异常代谢。这些潜在的生物标志物与炎症、凋亡、和血小板聚集有关。可初步为深入理解鸡缺硒心肌损伤代谢机制提供新的信息。
关键词 :鸡心肌细胞,缺硒,代谢组

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
硒(Selenium, Se)是人和动物必需微量元素,在禽类的生长发育、繁殖、免疫功能及抵抗疾病等方面发挥着重要生物学功能 [1] [2] [3] 。缺硒可以引起动物的出生率下降、健康受损、以及基于心肌退行性病变导致的出生病死率的提高。缺硒引发GSH-Px活性下降,过氧化物堆积,从而直接损伤细胞膜,尤其是线粒体膜。缺硒导致红细胞脆性增加表现出贫血以及内皮细胞膜受损出现肿胀等。研究发现,硒与心血管系统的结构、功能及其疾病的发生关系密切 [4] 。已知缺硒与克山病、动脉粥样硬化、冠心病等疾病的发生发展有明显相关性。因此,本文通过代谢学组技术分析讨论缺硒对雏鸡发育过程中心肌组织损伤前后的代谢物的变化,这些结果将对揭示在缺硒状态下鸡心肌发育损伤中的生物学功能及缺硒鸡心肌组织病变的可能机制具有重要意义。
2. 材料方法
2.1. 实验动物
取1日龄雏鸡,雌雄各半(购于哈尔滨市先锋孵化场),随机分为2组。缺硒组标记为L-Se组,饲喂来自于黑龙江省严重缺硒地区龙江县的缺硒日粮(日粮总含硒量为33 µg/kg);硒正常组标记为C-Se组,饲喂全价日粮,将缺硒组日粮添加Na2SeO3,使日粮总含硒量为0.15 mg/kg;各组雏鸡常规喂养,自由采食和饮水,饲喂35天。
2.2. 血浆样本的采集
正常组和缺硒组各取6只雏鸡,禁食过夜,次日清晨颈静脉采血5 mL,转移至含抗凝剂(EDTA-K3)的采血管中,3000 rpm室温离心10 min,保留上清液并分装,每份250 μL,共8份,于−80℃冰箱中保存备用。
2.3. 血浆样品预处理
血浆样品分析前,需对其进行预处理,步骤如下 [5] :(1) 取一份冻存血浆于冰上解冻,待完全解冻后,涡旋30 s;(2) 取200 μL血浆于2 ml离心管中,加入5倍体积的有机溶剂(甲醇),涡旋振荡2 min后静置,14000 rpm 离心10 min,以除去蛋白质;(3) 取上清液于2 mL离心管中,37℃下氮气吹干;(4) 向吹干的离心管内加入乙腈/水溶液(3:1, v/v)重新定容,涡旋振荡1 min后静置;(5) 将液体全部注入进样瓶,用于RRLC-QTOF/MS检测。
2.4. 血浆RRLC-QTOF/MS检测
使用RRLC (Reversed phase liquid chromatography)液相自动进样系统(Agilent公司),自动上样10 µL,分析柱为3.0 × 100 mm (1.8 μm) ZORBAX SB-C18色谱柱(Agilent Technologies, Santa Clara, CA),柱温设为40℃。色谱流动相采用含0.1%甲酸的水溶液(A)和乙腈溶液(B)。洗脱梯度条件为5%~95%的乙腈溶液,分析时间为38 min。样品检测温度为4℃。
质谱检测使用Agilent四级杆时间飞行色谱仪Q-TOF(Agilent Technologies, Santa Clara, CA),并采用电喷雾离子源的正离子模式(ESI+)和负离子模式(ESI-)。通过对影响样品离子化较大的参数脱溶剂气温度和流速、毛细管电压、fragment等优化,最终确定出本次实验样品离子化的最佳条件为:脱溶剂气温,350℃;脱溶剂气流量,10 L/h;毛细管电压在正离子和负离子模式下分别设定为4.0 kV和3.5 kV。图谱数据采集的质荷比范围为50~1000 m/z,采集扫描频率为0.5 s。
2.5. 样品数据采集的质控
本研究设立空白样品(blanks)和质量控制样品(quality control samples, QC) [5] ,并且进样时采取正常组和缺硒组样品合并质量控制样品(QC)交叉、随机进样。同时采用PCA方法分析血浆质控样品数据,观察血浆质控样是否出现集中趋势,以此验证本研究采用RRLC-QTOF/MS检测样品数据的可靠性。
2.6. 数据预处理
使用Agilent公司的定性软件将结果转化为mzdata文件,生成的数据文件导入R软件包,使用XCMS [6] [7] [8] [9] [10] 和CAMERA [11] [12] 进行数据预处理,其中,XCMS预处理的相关参数(如峰半腰峰宽、保留时间窗等)采用默认值 [13] ,并对样本数据进行归一化(normalized)和标准化(standardization)处理 [14] 。
2.7. 数据分析和模式识别
采用SIMCA-p 11.5 (Umetrics AB, Umea, Sweden)软件进行PCA [15] 和PLS-DA统计分析 [16] 。并采用PLS-DA模型置换检验验证建立的PLS-DA模型是否稳健有效,判定标准为:所有置换后的R2和Q2值均低于原始的R2和Q2值。借助于PLS-DA建模的VIP值和单变量的假设检验(the Welch’s t test)的P值得到生物标志物。生物标志物筛选标准为:VIP > 1.2并且 P值小于0.05。
2.8. 物标志物解析
以保留时间和质荷比作为基本定性信息,并根据CAMERA的化学标识信息排除了相同代谢物的同位素、碎片离子和加合物。然后根据保留时间、一级质谱及二级质谱获得的碎片离子信息确定代谢物的分子量和分子式;检索人类代谢组学数据库(HMDB)、Chemspider或Metlin等数据库得到具有相同质荷比物质的结构信息;再利用碎片识别软件将数据库中得到的化合物结构信息同该生物标志物的二级离子碎片信息进行匹配。针对找到生物标志物为切入点,检索国内外相关代谢组学数据库或有关的文献,逆向探索该生物标志物的代谢途径或生物学意义。
3. 结果
3.1. RRLC-QTOF/MS正离子模式下的血浆分析结果
3.1.1. 正常组和缺硒组的典型RRLC-QTOF/MS图谱
图1为正常组和缺硒组的血浆总离子流图。其中,上面代表的是正常组的色谱图,下面的图谱属于
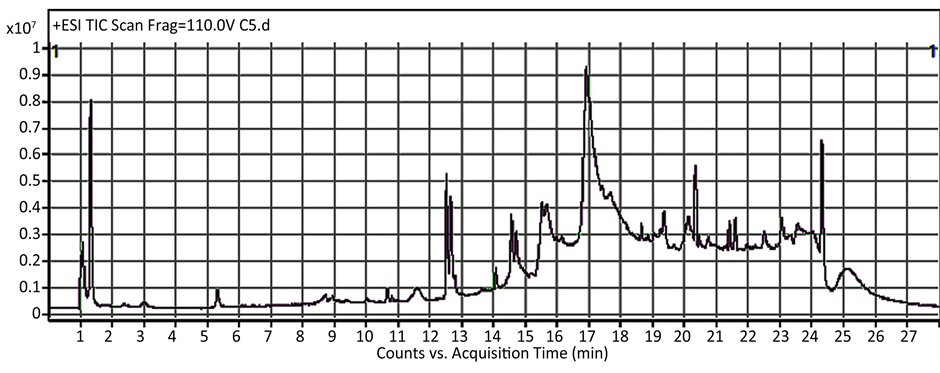
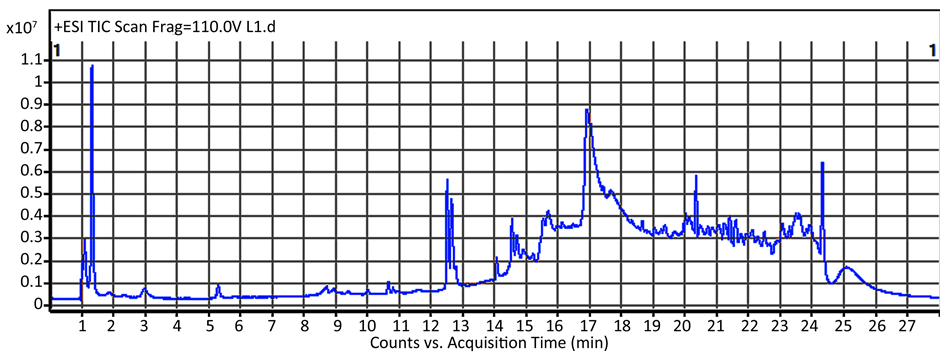
Figure 1. Typical RRLC-QTOF/MS chromatograms of plasma samples for normal and Se deficiency acquired in positive mode
图1. 正常和缺硒35d血浆正离子模式下的RRLC-QTOF/MS图谱
缺硒组,图谱中包括成千个血浆中的代谢物质。由图可见,二者的总离子流图中的谱峰大体上是一致的,我们无法直接从谱图上观察出两组的差异,说明两组间的差异可能是复杂、微弱的改变,因此需要采用统计分析和模式识别方法进一步挖掘出组间的差别和其中潜在的生物标志物。
3.1.2. 正常组和缺硒组的代谢组模式识别分析结果
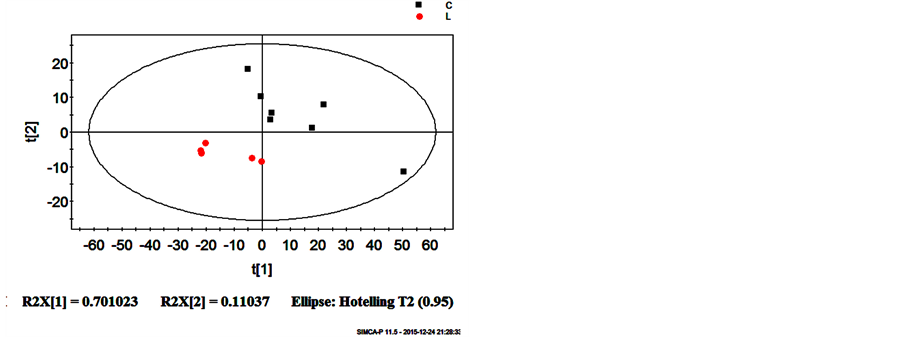
经XCMS软件对图谱进行预处理,结果显示(见图2),从PCA得分图可以看到,QC样品聚集在一起,说明代谢组学检测平台的稳定性和可靠性;同时,整体上没有观测到异常离群样本,C组与L组之间也具有一定的分离趋势。
从PLS-DA得分图可以看出,预筛选的离子峰变量都能将C组和L组明显分离开(图3(a))。PLS-DA模型置换检验验证图也显示,所建立的PLS-DA模型是稳健有效的(图3(b))。
3.1.3. 差异代谢物的筛选和物质鉴定
为了在近千个代谢物中寻找到区分两者的差异物质,基于所建立的PLS-DA模型并根据CAMERA分析得到的同位素、加合物和碎片离子信息,在排除上述离子后,最终共筛选出差异变量9个,详见表1。我们进一步对这些差异代谢物做化学结构鉴定和生物功能解析,以此来确定潜在的生物标志物。
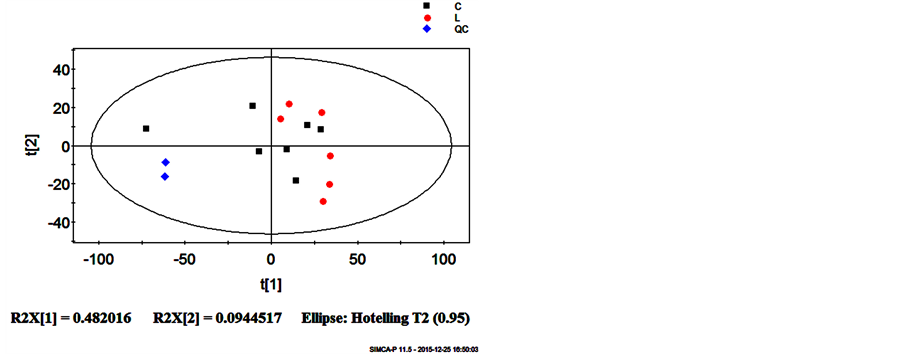
Figure 2. PCA scores plot for the top two components discriminates L (SeD group) from C(Control group ) based on the data from positive mode
图2. 正离子模式下的血浆代谢组PCA得分图
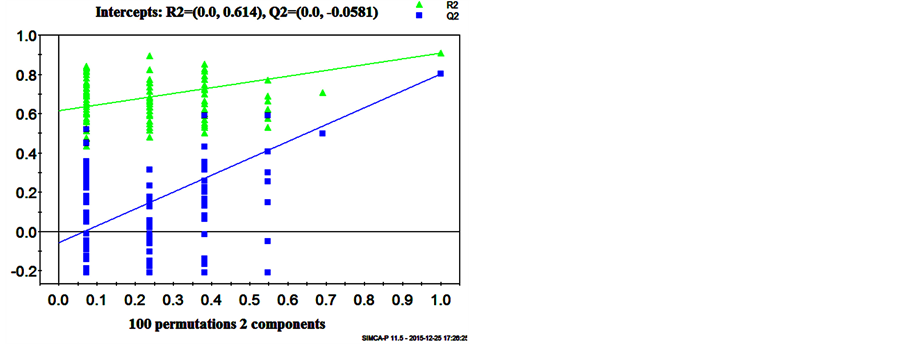
 (a) (b)
(a) (b)
Figure 3. (a) PLS-DA scores plot for C ( ) from L (●) based on the data from positive mode; (B) Validation plot obtained from 100 permutation tests based on the data from positive mode
图3. (a) PLS-DA模型得分图,正常组( )缺硒组(●);(b)100次随机置换的验证图
Table 1. Nine biochemical properties of a potential biomarker
表1. 9个潜在生物标志物的生物化学特性
3.2. RRLC-QTOF/MS负离子模式下的血浆分析结果
3.2.1. 正常组和缺硒组的典型RRLC-QTOF/MS图谱
图4为负离子模式下检测到的正常组和缺硒组典型的血浆总离子流图,图谱中包括了近千个代谢物质。如图所示,二者的总离子色谱图中的谱峰大体上是一致的,无法从谱图上直观地察看出组间的差别,因此需要采用统计分析方法进一步寻找组间的差别以及其中潜在的生物标志物。
3.2.2. 正常组和缺硒组的代谢组模式识别分析结果
采用XCMS软件对负离子模式获得的数据预处理后共得到316个代谢物,将各血浆样品投射到PCA模型的前两个主成分构建的得分图中可知(见图5),PCA分析方法无法正确显示两组样本的分类情况,组间具有较大的重叠部分。
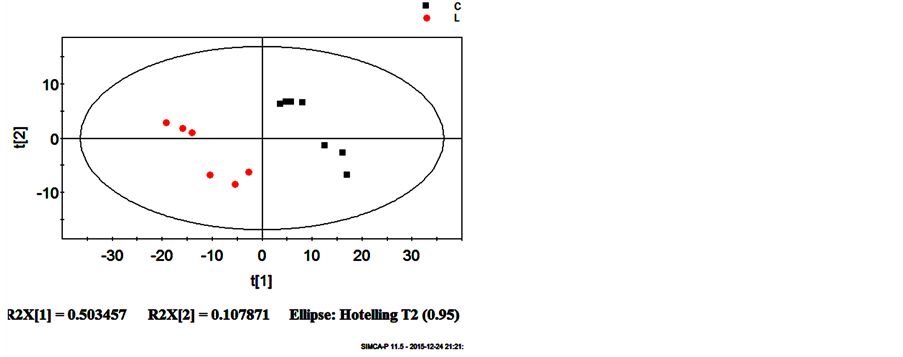
采用PLS-DA模型的前三个主成分构建得分图,如图6(a),结果显示,正常组和缺硒组间存在着明显的差异,两组间无交叉和重叠,表明两组动物体内的代谢模式明显不同。
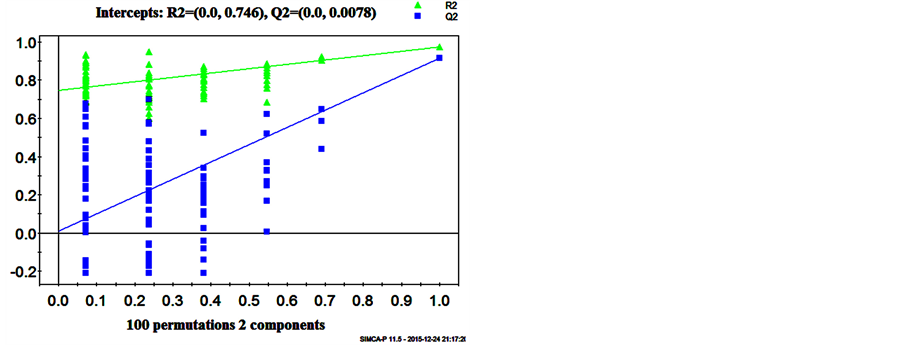
经过100次建模得到的PLS-DA模型验证图。图6(b)显示,经100次置换获得的Q2cum在0以下,表明本研究构建的PLS-DA模型较为稳健,没有过拟合危险,经过此PLS-DA模型分析得到的结果可靠。
3.2.3. 差异代谢物的筛选和物质鉴定
差异代谢物的筛选是代谢组学研究中最重要的步骤之一。本研究利用PLS-DA模型算得的VIP值结


Figure 4. Typical RRLC-QTOF/MS chromatograms of plasma samples for normal and Se deficiency acquired in negative mode
图4. 正常和缺硒35d血浆负离子模式下的RRLC-QTOF/MS图谱
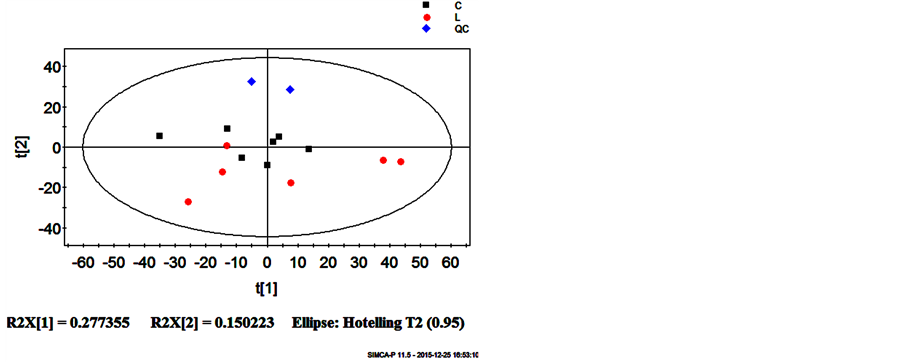
Figure 5. PCA scores plot for the top two components discriminates L (SeD group) from C(Control group ) based on the data from negative mode
图5. 负离子模式下的血浆代谢组PCA得分图
 (a) (b)
(a) (b)
Figure 6. (a) PLS-DA scores plot for C ( ) from L (●) based on the data from negative mode; (b) Validation plot obtained from 100 permutation tests based on the data from negative mode
图6. (a) PLS-DA模型得分图,正常组( ) 缺硒组(●);(b)100次随机置换的验证图
合单变量检验方法(the Welch's t test)算得的P值筛选出对样品分类有贡献的差异变量。然后根据CAMERA分析结果,删除多余的同位素离子、加合物和碎片离子,最终共筛选出对分组有贡献的变量7个,详见表2。
4. 讨论
前面的实验结果显示缺硒诱发鸡心肌损伤过程中发生了ERS、炎症反应、钙超载等生理事件,从而加速心肌细胞凋亡、组织损伤、器官衰竭。本部分研究以正常饲喂雏鸡作为对照组,使用RRLC-QTOF/MS检测血浆中的代谢物,从代谢组学上研究缺硒与对照的差异,并从中找到16个与其很可能有关联的生物标志物。
研究结果显示:代谢组学能够明显分开正常组和缺硒组。采用RF模式判别方法(1000种代谢物),通过交叉验证分析,显示了在正离子模式检测下,两组差别的AUC值为0.9044;在负离子模式检测下,
AUC值为0.7513。进而,用筛选出并推测出了其化学结构的16个内源性物质(包括正离子模式的9个标志物和负离子模式的7个物质),区分两组标本的AUC值为0.9143,表明使用这些标志物就能够很好地区分正常组和缺硒组。
根据KEGG,Wikipedia等查找发现16个代谢标志物分布在9个代谢通路中,其中5个相互关联而另外4个未找到关联,如图7所示。5个相互关联的途径分别是甘油磷脂代谢、脂类代谢、萜类化合物
Table 2. 7 biochemical properties of a potential biomarker
表2. 7个潜在生物标志物的生物化学特性

Figure 7. The network of the potential biomarkers for SeD according to the KEGG PATHWAY database (Blue letters on behalf of metabolic pathways;red frame FC > 0; green frame FC < 0)
图7. 根据KEGG路径数据库构建的缺硒潜在生物标志物网落图(蓝色字体代表代谢通路;红色框FC > 0,绿色框FC < 0)
的生物合成、视黄醇代谢以及吲哚生物碱生物合成;4个未找到关联的途径分别是蛋白质分解代谢、多环芳烃烃降、吡啶羧酸衍生物及其他。
在确定的16个代谢标志物中,有4个物质是上调的,其他12个物质都是下调。其中有三个物质是在先前的文献中有过报道与MI和氧化应激有关,分别是choline,Decenedioic acid and Leucine。在这三个物质中,Choline明确与冠心病的发生有关,其机制是胆碱参与炎症反应、斑块破裂和血小板聚集的细胞信号介导通路 [17] [18] 。Decenedioic acid是一种磷脂酰甘油(decenedioic acid) PG(16:0/16:0)作为合成心磷脂的前体,发现在缺硒组中下调,下调的甘油磷脂有可能通过心磷脂介导的凋亡诱导发生心肌损伤 [19] 代谢组学分析发现Leucine在缺硒组升高。Perez de Obanos等 [20] 提供了在一个细胞系统内由Leucine诱导ROS的证据。他们还报道了Leucine通过NADPH氧化酶和线粒体ROS的产生显示了前氧化物的作用。
我们研究发现:PC(15:0/14:0)是一种磷脂酰胆碱,在缺硒组的浓度降低。有研究报道升高的磷脂胆碱能够与血小板活化因子相互作用刺激血小板、中性粒细胞、单核细胞和巨噬细胞,产生炎症反应和血小板聚集 [21] 。但缺硒35天,可能处于损伤早期机体防御阶段而有所降低。据此,我们推测缺硒诱导的鸡心肌损伤机制,如图8所示。
根据统计分析结果,本研究在分析的第一阶段一共筛选出近千个物质。但本研究两组入选标准除饲料中硒含量不同外,使用饲喂方法基本上相同,具有一定的可比性。我们选择内源性的16个物质作为潜在的生物标志物,并对其中的13个标志物做了生物学途径的归类和解释,而其他4个标志物有待于进一

Figure 8. Pathogenesis of mycocardial injury in chickens with SeD (The pathological changes in blue were related to the results of the metabonomic study)
图8. 缺硒诱导鸡心肌损伤的发病机制(蓝色代表病理相关的代谢途径)
步研究。
总之,我们的研究显示用代谢组学方法可用来找出缺硒诱导鸡心肌损伤的生物标志物。在缺硒组中观察到甘油、磷脂、亮氨酸、类固醇等生化物质的异常代谢。这些潜在的生物标志物与炎症、凋亡、和血小板聚集有关。本研究筛选出的生物标志物可初步为深入地理解鸡缺硒心肌损伤代谢机制提供新的信息。在此基础上进一步针对靶向途径做定向检测及筛选,同时采取更大样本的多重对照研究以及其生物学实验有待后续工作继续进行。
基金项目
国自然课题(31272626)资助。
文章引用
刘 伟,姚海东,赵文超,孙 萌,徐世文. 鸡缺硒心肌损伤代谢组学分析
Metabonomics Analysis of Myocardial Injury Induced by Selenium Deficiency in Chicken[J]. 自然科学, 2017, 05(02): 126-136. http://dx.doi.org/10.12677/OJNS.2017.52018
参考文献 (References)
- 1. Köhrl, J., Brigelius-Flohé, R., Böck, A., Gärtner, R., Meyer, O. and Flohé, L. (2000) Selenium in Biology: Facts and Medical Perspectives. Biological Chemistry, 381, 849-864. https://doi.org/10.1515/bc.2000.107
- 2. Brown, K.M. and Arthur, J.R. (2001) Selenium, Selenoproteins and Human Health: A Review. Public Health Nutrition, 4, 593-599. https://doi.org/10.1079/PHN2001143
- 3. Li, J.G., Zhou, J.C., Zhao, H., Lei, X.G., Xia, X.J., Gao, G. and Wang, K.N. (2011) Enhanced Water-Holding Capacity of Meat Was Associated with Increased Sepw1 Gene Expression in Pigs Fed Selenium-Enriched Yeast. Meat Science, 87, 95-100. https://doi.org/10.1016/j.meatsci.2010.05.019
- 4. Wang, X., Zhang, X., Ren, X.P., Chen, J., Liu, H., Yang, J., Medvedovic, M., Hu, Z. and Fan, G.C. (2010) MicroRNA-494 Targeting Both Proapoptotic and Antiapoptotic Proteins Protects against Ischemia/Reperfusion-Induced Cardiac Injury. Circulation, 122, 1308-1318. https://doi.org/10.1161/CIRCULATIONAHA.110.964684
- 5. Bruce, S.J., Jonsson, P., Antti, H., Cloarecc, O., Tryggb, J., Marklundd, S.L. and Moritza, T. (2008) Evaluation of a Protocol for Metabolic Profiling Studies on Human Blood Plasma by Combined Ultra-Performance Liquid Chromatography/Mass Spectrometry: From Extraction to Data Analysis. Analytical Biochemistry, 372, 237-249. https://doi.org/10.1016/j.ab.2007.09.037
- 6. Smith, C.A., Want, E.J., O’Maille, G., Abagyan, R. and Siuzdak, G. (2006) XCMS: Processing Mass Spectrometry Data for Metabolite Profiling Using Nonlinear Peak Alignment, Matching, and Identification. Analytical Chemistry, 78, 779-787. https://doi.org/10.1021/ac051437y
- 7. Katajamaa, M. and Oresic, M. (2007) Data Processing for Mass Spectrometry-Based Metabolomics. Journal of Chromatography A, 1158, 318-328. https://doi.org/10.1016/j.chroma.2007.04.021
- 8. Katajamaa, M. and Oresic, M. (2005) Processing Methods for Differential Analysis of LC/MS Profile Data. BMC Bioinformatics, 6, 179. https://doi.org/10.1186/1471-2105-6-179
- 9. Castillo, S., Gopalacharyulu, P., Yetukuri, L. and Orešič, M. (2011) Algorithms and Tools for the Preprocessing of LC-MS Metabolomics Data. Chemometrics and Intelligent Laboratory Systems, 108, 23-32. https://doi.org/10.1016/j.chemolab.2011.03.010
- 10. Hendriks, M.M.W.B., Eeuwijk, F.A., Jellema, R.H., Westerhuis, J.A., Reijmers, T.H., Hoefsloot, H.C.J., Smilde, A.K. (2011) Data-Processing Strategies for Metabolomics Studies. TrAC Trends in Analytical Chemistry, 30, 1685-1698. https://doi.org/10.1016/j.trac.2011.04.019
- 11. Ralf Tautenhahn, C.B. and Neumann, S.E. (2007) Annotation of LC/ESI-MS Mass Signals. Springer, Berlin. https://doi.org/10.1007/978-3-540-71233-6_29
- 12. Kuhl, C. (2010) LC-MS Peak Annotation and Identification with CAMERA. 114.
- 13. Smith, C.A. (2005) LC/MS Preprocessing and Analysis with XCMS. Memory, 1-13.
- 14. Warrack, B.M., Hnatyshyn, S., Ott, K.H., Reily, M.D., Sanders, M., Zhang, H. and Drexler, D.M. (2009) Normalization Strategies for Metabonomic Analysis of Urine Samples. Journal of Chromatography B, 877, 547-552. https://doi.org/10.1016/j.jchromb.2009.01.007
- 15. Trygg, J., Holmes, E. and Lundstedt, T. (2007) Chemometrics in Metabonomics. Journal of Proteome Research, 6, 469-479. https://doi.org/10.1021/pr060594q
- 16. Boulesteix, A.L. and Strimmer, K. (2007) Partial Least Squares: A Versatile Tool for the Analysis of High-Dimen- sional Genomic Data. Briefings in Bioinformatics, 8, 32-44. https://doi.org/10.1093/bib/bbl016
- 17. Park, Y.H., Jeon, Y.H. and Kim, I.Y. (2012) Selenoprotein W Promotes Cell Cycle Recovery from G2 Arrest through the Activation of CDC25B. Biochimica et Biophysica Acta, 1823, 2217-2226. https://doi.org/10.1016/j.bbamcr.2012.09.001
- 18. Wu, A.H.B., Crosby, P. and Fagan, G. (2003) Ischemia-Modified Albumin, Free Fatty Acids, whole Blood Choline, B-Type Natriuretic Peptide, Glycogen Phosphorylase BB, and Cardiac Troponin. In: Wu, A.H.B., Ed., Cardiac Markers, 2nd Edition, Humana Press, Totowa, 259-277.
- 19. Belikova, N.A., Vladimirov, Y.A., Osipov, A.N., Kapralov, A.A., Tyurin, V.A., Potapovich, M.V., Basova, L.V., Peterson, J., Kurnikov, I.V. and Kagan, V.E. (2006) Peroxidase Activity and Structural Transitions of Cytochrome C Bound to Cardiolipin-Containing Membranes. Biochemistry, 45, 4998-5009. https://doi.org/10.1021/bi0525573
- 20. Danne, O., Möckel, M., Lueders, C., Mügge, C., Zschunke, G.A., Lufft, H., Müller, C. and Frei, U. (2003) Prognostic Implications of Elevated Whole Blood Choline Levels in Acute Coronary Syndromes. American Journal of Cardiology, 91, 1060-1067. https://doi.org/10.1016/S0002-9149(03)00149-8
- 21. Pérez de Obanos, M.P., López-Zabalza, M.J., Arriazu, E., Modola, T., Prieto, J., Herraizc, M.T. and Iraburu, M.J. (2007) Reactive Oxygen Species (ROS) Mediate the Effects of Leucine on Translation Regulation and Type I Collagen Production in Hepatic Stellate Cells. Biochimica et Biophysica Acta, 1773, 1681-1688. https://doi.org/10.1016/j.bbamcr.2007.07.005
