Material Sciences
Vol.06 No.04(2016), Article ID:18117,7
pages
10.12677/MS.2016.64033
Preparation and Release Performance in Vitro of Chitosan Microspheres/nHA/PLGA Compound Scaffolds
Yan Bai*, Wei Xiao
College of Pharmacy, Chongqing Medical University, Chongqing

Received: Jul. 1st, 2016; accepted: Jul. 25th, 2016; published: Jul. 28th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In order to construct a bone regeneration scaffold that different growth factors controlled release at proper stage, Trypsin (Try) was selected as the model protein. The composite of sustained-re- lease microspheres and biodegradable porous scaffolds was prepared in this study. Firstly, Trypsin-chitosan microspheres (CMs) were prepared. Then, Trypsin-CMs were compounded to the nano hydroxyapatite/poly lactic-co-glycolic acid (nHA/PLGA) to build a scaffold that could release growth factors sequentially. The results showed that the Try-CMs were spherical shape with diameters of 4 - 10 μm. The encapsulation efficiency of the Trypsin in CMs was 61.33%, and the loading capacity was 25.699%. The prepared Try-CMs/nHA/PLGA scaffold possessed 100 - 200 μm pore diameter, 53.24% porosity, 7.31 MPa compressive strength, and 19.92% degradation at 8 weeks. The cumulative releases of Trypsin from Try-nHA/PLGA, Try-CMs and Try-CMs/nHA/PLGA scaffolds were respectively about 57.31%, 69.32% and 26.03% at 48 hours, 77.89%, 85.73% and 54.53% at 14 days. The results demonstrated that Try-CMs/nHA/PLGA scaffolds had excellent drug sustained-release performance, which would be used as tissue engineering scaffolds with protein controlled delivery.
Keywords:Chitosan, Poly Lactic-Co-Glycolic Acid, Composite Scaffolds, Controlled Release

CMs/nHA/PLGA复合支架的制备及体外释放性能的研究
白燕*,肖唯
重庆医科大学药学院,重庆

收稿日期:2016年7月1日;录用日期:2016年7月25日;发布日期:2016年7月28日

摘 要
本研究以胰蛋白酶(Try)为模型蛋白,将壳聚糖缓释微球与可降解多孔支架复合,构建可次第释放不同生长因子的骨组织工程支架。首先,制备载胰蛋白酶的壳聚糖微球(Try-CMs),然后将微球与纳米羟基磷灰石/羟基乙酸(nHA/PLGA)按照一定的比例混合,通过粒子沥虑–冷冻干燥复合工艺制备Try-CMs/ nHA/PLGA复合支架。结果表明,制备的Try-CMs呈规则球形,粒径分布在4~10 μm之间,胰蛋白酶包封率为61.33%,载药量为25.69%。制备的Try-CMs/nHA/PLGA复合支架孔径为100~200 μm,孔隙率为53.24%,抗压强度为7.31 MPa,8周降解率为19.92%。48 h,Try-nHA/PLGA、Try-CMs、Try-CMs/nHA/ PLGA复合支架累计释放率分别57.31%、69.32%和26.03%;14天时,Try-nHA/PLGA、Try-CMs和Try-CMs/nHA/PLGA复合支架的累计释放率分别为77.89%、85.73%和54.53%。Try-CMs/nHA/PLGA复合支架对蛋白药物具有良好的缓释作用,有望作为具有蛋白类药物缓释作用的组织工程支架。
关键词 :壳聚糖,羟基乙酸,复合支架,控释

1. 引言
骨组织的再生和修复是一个涉及到多种生长因子协同作用的复杂过程 [1] 。迅速有效的血管重建是骨修复的前提和保障 [2] 。研究证明,在骨修复的过程中,血管形成发生在骨形成之前,血管生长因子的表达明显早于骨生长因子 [3] 。因此,为了模拟生理条件下骨修复过程中生长因子的作用模式,需要构建一种能够次第释放不同生长因子的控释载体,即先释放诱导血管生成的生长因子,再释放诱导骨生成的生长因子。但目前常采用单一的微球或支架为缓释载体,未考虑生长因子应用的时间依赖性。如将微球和支架结合应用,分别将不同生长因子载入微球和支架,达到次第释放的目的,有望更好的实现骨修复。
壳聚糖是甲壳素脱N-乙酰基的产物,无毒无刺激性,具有良好的生物相容性和生物降解性,能被生物体完全吸收等特点 [4] ,因此用它作药物缓释剂具有较大的优越性。羟基乙酸(PLGA)具有优良的可降解性和生物相容性,在体内可被降解为二氧化碳和水,而且降解速率可通过相对分子量控制,被广泛的用作细胞支架和药物载体材料 [5] 。羟基磷灰石(HA),是牙齿和骨骼中重要的无机成分,不但能诱导细胞增殖和分化 [6] ,而且可增强材料的机械强度。将HA与PLGA进行复合,既可增加骨传导性,又能提高支架材料的机械强度,且能够调节PLGA的降解速率,以保证材料的降解速度与骨组织的再生速度一致 [7] 。
本实验以胰蛋白酶为模型药物,先将胰蛋白酶载入壳聚糖微球中制备Try-CMs,再按照一定的比例将将Try-CMs载入nHA/PLGA支架中制备Try-CMs/nHA/PLGA复合支架。考察三种载体中胰蛋白酶的释放特性,拟构建一种能够以不同速率释放生长因子的载体系统。
2. 材料和方法
2.1. 材料
壳聚糖(MW = 25,000,脱乙酰度 > 98%,阿拉丁),PLGA (济南岱罡生物工程有限公司),羟基磷灰石(阿拉丁),Trypsin (美国Sigma公司),BCA试剂盒(南京建成生物工程研究所)。
2.2. Try-CMs的制备
称取0.2 g壳聚糖,溶于2%的冰乙酸中,终浓度为1.0 g/L,过滤,调节pH值至5.0~6.0备用。在Try冻干粉中加入PBS溶解配制成工作液,取2 ml壳聚糖溶液,加入适量Try工作液,持续冰浴搅拌,同时缓慢滴加2.5 g/L的三聚磷酸钠500 ul,继续磁力搅拌10 min。10,000 r/min低温离心20 min,所得沉淀用预冷的纯水洗涤3遍,离心弃去上清液,将得到的样品冷冻干燥,−20℃保存备用。
2.3. Try-CMs/nHA/PLGA复合支架的制备
以冰粒子为致孔剂,采用粒子沥滤–冷冻干燥复合工艺制备Try-CMs/nHA/PLGA复合支架 [8] 。首先制备致孔剂冰粒子。把蒸馏水喷液氮中,在表面张力的作用下,骤冷的液滴冻结得到近球形的冰粒子用分样筛筛分后,选取125~355 μm尺寸范围的冰粒子,储备待用。将0.5 g PLGA溶于5 ml二氯甲烷中,配成10% (W/V)的溶液。待PLGA完全溶解后,加入0.1 g羟基磷灰石,超声分散均匀。再加入适量Try-CMs,搅拌混合均匀。将上述混合液预冷,按照质量比为PLGA/冰粒子 = 1:9加入适量冰粒子,混匀后浇注于聚四氟乙烯模具中,将模具置于液氮中冷冻过夜。样品完全冻结后脱模,冷冻干燥48 h,即得Try-CMs/ nHA/PLGA复合支架。
2.4. 壳聚糖微球和复合支架形态观察
将Try-CMs分散到导电胶上,喷金,观察微球的表面形貌。取数块制备的复合支架,喷金后观察(JSM-5900LV,Japan)支架内部结构形态。
2.5. 微球载药量和包封率测定
将Try-CMs载药微球悬液于4℃,15,000 r/min离心45 min,取上清液,BCA试剂盒测定游离的胰蛋白酶浓度,计算微球的包封率和载药率。根据2010年版《中华人民共和国家药典》规定,载药量和包封率分别按以下公式计算:
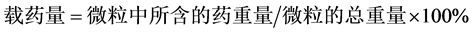
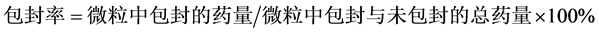
2.6. 支架机械强度测定
将样品制备成为直径为5 mm,高度为10 mm左右的圆柱体,即长径比为约2:1的标准复合材料试样,在万能测试机(日本SHIMADZU AUTOGRAPH)上进行抗压强度的测试。以三个样品为一组,设定压缩的行程为25%,下降速率控制在1 mm/min,在25%之前断裂的样品,断裂强度记为样品的强度;如没有断裂则在压缩25%过程中最大的强度即为样品的强度。三个样品的强度取平均值作为样品的抗压强度。
2.7. 支架孔隙率测定
称量样品的干重记为G1,测量样品的长度L及半径R,将样品放入二次水中抽真空,等水完全渗入到材料中时,即材料表面没有气泡冒出。取出样品,用滤纸吸干表面的水分,称重,称重记为G2,根据公式计算孔隙率:
2.8. 支架降解实验
将样品制备成为直径为5 mm,高度为10 mm左右的圆柱体,称重记为M0,浸泡于pH 7.4的PBS中,抽真空,使样品充分润湿,放入50 mL磨口瓶中,加入一定量的PBS溶液,放入37℃恒温水浴摇床内。分别于时间点0,1,2,3,4,6,8,10,12周取样,去离子水冲洗,冻干后称重记为MT,根据公式计算质量损失:

2.9. 胰蛋白酶体外释放实验
精密称取一定量的Try-CMs/nHA/PLGA复合支架,以pH 7.4的PBS 100 mL为释放介质,置于37℃恒温摇床中摇动。每隔一定的时间取出1 mL上清液,并补充等量的PBS,用试剂盒检测试剂盒检测蛋白含量,计算累积释放率。
3. 实验结果
3.1. 微球和复合支架的形态
如图1,Try-CMs形态呈规则的球星,表面光滑,大小比较均一,微球粒径分布集中在4~10 μm之间,平均粒径为6 μm。
制备的复合支架表面粗糙多孔,孔径主要分布在100~200 μm,孔的连通性较好,具有较高的孔隙率,见图2。
3.2. 复合支架孔隙率和抗压强度
不同含量的HA对CMs/nHA/PLGA复合支架的抗压强度和孔隙率的影响,见表1。随着HA的含量逐渐增大,复合支架的孔隙率随之逐渐减小,抗压强度随之逐渐增大。当HA的含量为5%时,复合支架的孔隙率最大为71.44%,而抗压强度最小为6.19 MPa;当HA的含量达到20%时,复合支架孔隙率为41.05%,抗压强度为8.25 MPa。综合考虑骨修复支架材料对孔隙率和抗压强度的影响,最终选用HA含量为15%,CMs/nHA/PLGA复合支架孔隙率为53.24%,抗压强度为7.31 MPa。
3.3. 壳聚糖微球载药量和包封率测定
胰蛋白酶包封率为61.33%,载药量为25.69%,所制备的微球具有良好的载药性能。
3.4. 复合支架的降解和蛋白的释放
随着降解时间的延长,支架材料的质量逐渐减小。降解到第2,4,6,8,10周时,复合支架的质量分别减少3.41%,6.79%,13.42%,19.92%,25.73%。Try-CMs和Try-nHA/PLGA复合支架中释放的胰蛋白酶都存在突释现象,而Try-CMs/nHA/PLGA的突释现象不明显。如图3,48 h,Try-nHA/PLGA、Try-CMs、Try-CMs/nHA/PLGA复合支架累计释放率分别57.31%,69.32%和26.03%;14天时,Try-nHA/PLGA、Try-CMs和Try-CMs/nHA/PLGA复合支架的累计释放率分别为77.89%,85.73%和54.53%。

Figure 1. SEM micrographs of Try-CMs
图1. Try-CMs的SEM图片

Figure 2. SEM micrographs of composite scaffolds
图2. 复合支架的SEM图片

Figure 3. Cumulative release of Trypsin from Try-CMs, Try-nHA/PLGA and Try-CMs/nHA/PLGA scaffold
图3. Try-CMs、Try-nHA/PLGA和Try-CMs/nHA/PLGA复合载体中胰蛋白酶的释放
Table 1. Effect of HA weight on CMs/nHA/PLGA scaffold properties
表1. 不同羟基磷灰石含量对CMs/nHA/PLGA支架性质的影响
21天时,Try-nHA/PLGA、Try-CMs和Try-CMs/nHA/PLGA复合支架的累计释放率分别为80.24%,86.05%和61.56%。
4. 讨论
在骨形成、发育及修复的复杂多因素过程中,生长因子的调控作用至关重要。生长因子的作用效应具有时间依赖性、剂量依赖性和协同作用 [9] 。为了充分发挥不同生长因子的生物效应,需要构建一种安全有效的控释系统,能够按照一定的时间和顺序释放生长因子到所需要的靶细胞,从而诱导细胞的生长和分化,有效促进组织再生修复。理想的控释载体应具备以下要求 [10] :具有良好的生物相容性,优良的理化性质(包括大小、形貌、机械强度、孔隙率等),对药物具有较高的包封率和载药量,良好的生物可降解性和控释性能。
实验制备复合载体所采用的三种基本材料壳聚糖、HA和PLGA都是使用较广泛、生物相容性优良的载体材料 [10] 。壳聚糖 [11] 是天然高分子材料,主要来源于自然界,具有良好的生物相容性、可降解性,易与细胞及体内的有机和无机大分子发生相互作用,不易引起机体免疫反应。将壳聚糖制备成载药微球可以达到药物靶向输送和控制释放的目的,是一种优良的载体材料。本研究制备的Try-CMs制备方法快速简单易行,重复性较好,且制备条件温和、无毒无刺激,能够最大限度地保证生长因子原有的构象和生物活性。实验所制备的载药微球形态规则,光滑完整,无粘连,微球粒径分布较集中,在4~10 μm之间,平均粒径为6 μm,且具有较高的载药量和包封率,减少浪费,利用率较高。PLGA无刺激、无毒、无致癌性,具有生物相容性和生物降解性,在体内能完全降解为乳酸和乙酸,再经过三羧酸循环转化为水和二氧化碳排至体外,因此在医药领域中应用极为广泛 [12] 。目前,PLGA生物降解材料已被FDA批准用于药物输送系统,将PLGA制备成生长因子的缓释载体,改进了药物的输送方法,弥补了壳聚糖机械强度不足的缺点,达到了药物可控释放的目的,提高药效,降低药物刺激性。在生长因子缓控释载体的制备过程中,可以根据不同生长因子的性质和释药时间,通过调整PLGA的组成、分子量及制备参数和工艺等,来控制药物的释放速率。本实验制备的CMs/nHA/PLGA复合支架孔径主要分布在100~200 μm,孔的连通性较好,能够满足骨组织修复的要求。实验采用冷冻干燥法并利用冰粒子作为致孔剂,低温环境可有有效保证生长因子的生物活性,且避免了以氯化钠致孔剂导致的致孔剂残留问题。HA是骨骼的组成部分,不但具有良好的生物相容性,而且能够辅助骨骼的生长 [13] 。我们将HA和PLGA复合制备支架,兼具两者的优势。HA能够显著提高PLGA支架材料的抗压强度,实验证明,随着HA含量的增大,支架的抗压强度增大但孔隙率减小,根据骨修复材料对孔隙率和抗压强度的要求,HA的含量为15%时CMs/nHA/PLGA复合支架孔隙率为53.24%,抗压强度为7.31 MPa,较为适宜。
Try-CMs/nHA/PLGA复合支架中胰蛋白酶的释放速率明显慢于Try-CMs中胰蛋白酶的释放速率。48 h,Try-nHA/PLGA、Try-CMs、Try-CMs/nHA/PLGA复合支架累计释放率分别57.31%,69.32%和26.03%;14天时,Try-nHA/PLGA、Try-CMs和Try-CMs/nHA/PLGA复合支架的累计释放率分别为77.89%、85.73%和54.53%。21天时,Try-nHA/PLGA、Try-CMs和Try-CMs/nHA/PLGA复合支架的累计释放率分别为80.24%、86.05%和61.56%。Try-CMs/nHA/PLGA复合支架能够对蛋白起到二次缓释的作用,有望实现生长因子的次第释放。
实验构建的Try-CMs/nHA/PLGA复合载体具体良好的缓释作用,有望实现不同生长因子的次第释放,为更好的促进骨修复奠定基础。
基金项目
国家自然科学基金资助项目(编号:81401535)。
文章引用
白 燕,肖 唯. CMs/nHA/PLGA复合支架的制备及体外释放性能的研究
Preparation and Release Performance in Vitro of Chitosan Microspheres/nHA/PLGA Compound Scaffolds[J]. 材料科学, 2016, 06(04): 256-262. http://dx.doi.org/10.12677/MS.2016.64033
参考文献 (References)
- 1. Deschaseaux, F., Sensébé, L. and Heymann, D. (2009) Mechanisms of Bone Repair and Regeneration. Trends in Molecular Medicine, 15, 417-429. http://dx.doi.org/10.1016/j.molmed.2009.07.002
- 2. Nakano, K., Murata, K., Omokawa, S., et al. (2016) Promo-tion of Osteogenesis and Angiogenesis in Vascularized Tissue-Engineered Bone Using Osteogenic Matrix Cell Sheets. Plastic & Reconstructive Surgery, 137, 1476-1484. http://dx.doi.org/10.1097/PRS.0000000000002079
- 3. Kanczler, J.M., Ginty, P.J., White, L., et al. (2010) The Effect of the Delivery of Vascular Endothelial Growth Factor and Bone Morphogenic Protein-2 to Osteoprogenitor Cell Populations on Bone Formation. Biomaterials, 31, 1242- 1250. http://dx.doi.org/10.1016/j.biomaterials.2009.10.059
- 4. Wang, Q., Hua, Q. and Wang, S. (2007) Application of Fibrin Glue in Facial Nerve Repair. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 24, 612-614.
- 5. Thevenot, P.T., Nair, A.M., Shen, J.H., Lotfi, P., Ko, C.-Y. and Tang, L.P. (2010) The Effect of Incorporation of SDF- 1α into PLGA Scaffolds on Stem Cell Recruitment and the Inflammatory Response. Biomaterials, 31, 3997-4008. http://dx.doi.org/10.1016/j.biomaterials.2010.01.144
- 6. Ambrosio, A.M., Sahota, J.S. and Khan, Y. (2001) A Novel Amor-phous Calcium Phosphate Polymer Ceramic for Bone Repair: I. Synthesis and Characterization. Journal of Biomedical Materials Research, 58, 295-301. http://dx.doi.org/10.1002/1097-4636(2001)58:3<295::AID-JBM1020>3.0.CO;2-8
- 7. 赵君, 蒋欣泉, 张志愿. 羟磷灰石/聚乙丙交酯生物复合材料的研究进展[J]. 国际口腔医学杂志, 2008, 35(2): 207- 209.
- 8. 安世昌, 孙健, 李亚莉等. 复合壳聚糖纳米微球聚乳酸–羟基乙酸/纳米羟基磷灰石缓释载体系统对蛋白的缓释作用[J]. 中国组织工程研究与临床康复, 2011, 15(25): 4615-4618.
- 9. Bai, Y., Yin, G.F., Huang, Z.B., et al. (2013) Localized Delivery of Growth Factors for Angiogenesis and Osteogenesis in Tissue Engineering. International Immunopharmacology, 2, 214-223. http://dx.doi.org/10.1016/j.intimp.2013.04.001
- 10. Maekawa, T. (2011) Polymeric Scaffolds in Tissue Engineering Application: A Review. International Journal of Polymer Science, 2011, 609-618.
- 11. Sun, Y., Wang, J., Feng, Z., et al. (2016) The Preparation and Characteristics of Spray Dried Astragalus Polysaccharides/Chitosan Microspheres for Pulmonary Drug Delivery. Nanomedicine Nanotechnology Biology & Medicine, 12, 565-565. http://dx.doi.org/10.1016/j.nano.2015.12.331
- 12. Morille, M., Toupet, K., Montero-Menei, C.N., et al. (2016) PLGA-Based Microcarriers Induce Mesenchymal Stem Cell Chondrogenesis and Stimulate Cartilage Repair in Osteoarthritis. Biomaterials, 88, 60-69. http://dx.doi.org/10.1016/j.biomaterials.2016.02.022
- 13. Cui, H.X., Guo, J., Han, Z., et al. (2015) Biocompatibility of Differ-ently Proportioned HA/PLGA/BMP-2 Composite Biomaterials in Rabbits. Genetics & Molecular Research GMR, 14, 13511-13518. http://dx.doi.org/10.4238/2015.October.28.12
*通讯作者。
