Hans Journal of Food and Nutrition Science
Vol.04 No.04(2015), Article ID:16426,7
pages
10.12677/HJFNS.2015.44019
To Explore the Process Conditions of Extracting Proanthocyanidins from “JuFeng” Grape Skin by Ethanol
Zhi Tang1*, Xiaopei Luo2, Lixin Xu2, Yanli Cao1, Nannan He1, Jinglei Zhang3
1Department of Bio-Engineering, College of Life Sciences, Jilin University, Changchun Jilin
2College of Life Sciences, Jilin University, Changchun Jilin
3Department of Food Quality and Safety, College of Food Science and Engineering, Jilin University, Changchun Jilin
Received: Nov. 1st, 2015; accepted: Nov. 23rd, 2015; published: Nov. 27th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Proanthocyanidin is a kind of active substance with high health and medicinal value. Grape skins are natural materials which are cheap and easy to get. The grape skins include higher levels of proanthocyanidins. The extraction process for Proanthocyanidins from grape skins by ethanol was investigated in this paper, the effects of ethanol concentration, extraction temperature, extraction time and ratio of solid to liquid on the yield of extraction were evaluated. With the extraction yield as index, the suitable extraction conditions are determined by the single factor. The results show that suitable extraction conditions of extracting Proanthocyanidins from “JuFeng” grape skin by ethanol are as follows: ethanol concentration is 50%, extraction temperature is 50˚C, extraction time is 60 min and ratio of solid to liquid is 1:5 (0.25 mg:5 mL). This method can provide a guidance for proanthocyanidins extraction from grape skins by ethanol.
Keywords:Ethanol, Proanthocyanidins, Grape Skins, Extract

乙醇提取“巨峰”葡萄皮中的原花青素 的工艺条件探究
唐智1*,骆晓沛2,徐立昕2,曹艳丽1,赫楠楠1,张婧蕾3
1吉林大学生命科学学院生物工程系,吉林 长春
2吉林大学生命科学学院,吉林 长春
3吉林大学食品科学与工程学院食品质量与安全系,吉林 长春

收稿日期:2015年11月1日;录用日期:2015年11月23日;发布日期:2015年11月27日

摘 要
原花青素具有较高的保健和药用价值。葡萄皮是廉价易得的天然材料,且原花青素含量较高。本文采用乙醇对葡萄皮中原花青素进行了提取,研究了乙醇体积分数、浸提温度、浸提时间、料液比对提取效果的影响。以原花青素的提取含量为指标,通过单因素试验确立了影响原花青素提取量的适宜条件。实验结果表明,“巨峰”葡萄皮中原花青素提取适宜条件分别为:乙醇体积分数50%、浸提温度50℃、浸提时间60 min、料液比为1:5 (0.25 mg:5 mL)。本实验为从葡萄皮中提取原花青素提供了参考。
关键词 :乙醇,原花青素,葡萄皮,提取

1. 引言
原花青素(简称为PC)是植物王国中广泛存在的一大类黄烷-3-醇衍生物的总称,因为其独特的生理保健功能,近年来倍受国内外研究人员的重视,可添加在食品、药品、化妆品中,发挥保健作用[1] 。原花青素拥有强有力的抗氧化、清除自由基[2] [3] 及改善体循环的特殊功效,并有防止心血管疾病、抗肿瘤、抗辐射、防血小板凝结的作用。研究表明,原花青素在体内的抗氧化能力是维生素E的50倍,维生素C的20倍,且吸收迅速完全,口服20 min即可达到最高血液浓度,代谢半衰期达7 h之久[4] 。原花青素广泛存在于葡萄、苹果、松树等植物中的各个部位,在原花青素研究领域,葡萄一直是人们所密切关注的对象[5] 。在葡萄为原材料的研究中发现,葡萄籽的种皮中原花青素含量较高。而寻找新的富含原花青素的资源和适合于工业提取原花青素的是目前研究的热点[6] 。原花青素的含量测定方法有可见分光光度法[7] 、紫外分光光度法[8] 、原子吸收法[9] 、其他方法[10] 等。目前,国内外大多数文献介绍的提取方法大致有超声波提取法[11] -[13] 、超临界提取法、有机溶剂萃取法[14] 、酶提取法以及响应面优化法[15] -[17] 等。综合比较来看,有机溶剂萃取法以其成本小、规模化大,局限条件少的特点仍占较大的优势。
葡萄皮是廉价易得天然材料,原花青素含量较高。本文主要研究用乙醇提取葡萄皮中原花青素的工艺影响条件,探究了乙醇浓度,萃取时间,料液比以及温度对提取效果的影响。原花青素在紫外280 nm处有最大吸收[1] ,利用此特点测定提取工艺中的原花青素含量高低。实验结果对原花青素的提取工艺有一定的指导作用。
2. 材料与方法
2.1. 材料
2.1.1. 材料与试剂
“巨峰”葡萄(市售,吉林生产)、原花青素标准品(上海源叶生物科技有限公司)、无水乙醇(北京化工厂)、蒸馏水。
2.1.2. 仪器与设备
UV-1700紫外–可见光分光光度计、干燥箱、具塞试管、水浴锅、分析天平等。
2.2. 方法
2.2.1. 实验原理
本实验使用紫外分光光度法测定原花青素的含量。以原花青素在紫外280 nm附近处有最大吸收波长为原理,通过制备原花青素标准溶液检测最大波长、以及测定绘制标准曲线,以此来测定实验中的原花青素提取量。采用单因素实验,改变单一实验条件,以原花青素标准曲线以及回归方程为指标,从而测定求出实验提取量,进而比较得出各因素的最适宜条件。
2.2.2. 葡萄皮材料的制备
新鲜的葡萄颗粒取皮,用清水冲洗沥干后烘干后揉碎备用。
2.2.3. 原花青素标准溶液的配制
准确称量0.0130 g干燥的原花青素标准品用无水乙醇溶解后,定容到250 mL,摇匀,制得浓度为52 ug/mL的标准应用液。分别取上述标准应用液0.00、2.00、4.00、6.00、8.00、10.00 mL至试管中,加入无水乙醇,定容至10 mL。得到浓度分别为0.00、10.40、20.80、31.20、41.60、52.00 ug/mL的标准系列溶液。
2.2.4. 检测波长的确定
用无水乙醇作空白对照,采用上述41.60 ug/mL标准溶液,在波长为240~320 nm范围内测定吸光度值,作曲线,得出最大吸收波长为280 nm,以此为后续的检测波长。
2.2.5. 标准曲线的绘制
以无水乙醇为空白对照,在280 nm下测定上述标准系列溶液吸光度,绘制出吸光度–浓度标准曲线,并计算出回归方程。
2.2.6. 乙醇溶液提取葡萄皮中原花青素的影响因素探究
(1) 乙醇浓度的影响
配制体积分数为0、20%、30%、40%、50%、60%、70%、80%的乙醇溶液各100 mL,将24支试管分为8组,每组三支试管,准确称取已烘干的葡萄皮粉碎物0.25 g置于提取每支试管中,依次在每组试管中加10 mL 0、20%、30%、40%、50%、60%、70%、80%的乙醇溶液,震荡摇匀后开始放入50℃水浴锅中水浴加热,60 min时取每支试管上清液稀释10倍测定其在280 nm下的吸光度,每组三支试管求平均值,根据标准曲线方程求出提取量,绘制提取量–浓度曲线图。
(2) 提取时间的影响
取3支试管,准确称取已烘干的葡萄皮粉碎物0.25 g置于提取每支试管中,依次在每组试管中加10 mL 50%乙醇溶液,震荡摇匀后开始放入50℃水浴锅中水浴加热,每隔10 min取每支试管上清液稀释10倍测定其在280 nm下的吸光度,每组三支试管求平均值,根据标准曲线方程求出提取量,绘制提取量–提取时间曲线图。
(3) 提取温度的影响
将12支试管分为4组,每组三支试管,准确称取已烘干的葡萄皮粉碎物0.25 g置于提取每支试管中,依次在每组试管中加10 mL 50%的乙醇溶液,四组试管依次分别放入到30℃、40℃、50℃、60℃的水浴锅中提取60 min左右后取每支试管上清液稀释10倍测定其在280 nm下的吸光度,每组三支试管求平均值,根据标准曲线方程求出提取量,绘制提取量–提取温度曲线图。
(4) 料液比的影响
将15支试管分为5组,每组三支试管,准确称取已烘干的葡萄皮粉碎物0.25 g置于提取每支试管中,按料液比(0.25 g/mL)为1:2.5、1:5、1:10、1:15、1:20依次在每组试管中加2.5 mL、5.0 mL、10 mL、15 mL、20 mL 50%的乙醇溶液,震荡摇匀后开始放入50℃水浴锅中水浴加热,60 min时取每支试管上清液稀释10倍测定其在280 nm下的吸光度,每组三支试管求平均值,根据标准曲线方程求出提取量,绘制提取量–料液比曲线图。
3. 结果与分析
3.1. 原花青素标准曲线
其中吸光度值A与原花青素标准溶液浓度C之间的回归方程:A = 0.0150C + 0.0108 (A为280 nm下的吸光度,C为原花青素质量浓度,单位ug/mL),相关系数R = 0.9978。标准曲线见图1。
3.2. 乙醇溶液的最佳体积分数
按照(1)的设计,实验结果见图2。通过实验可知,乙醇溶液的浓度在体积分数为50%之前,原花青素提取量值随着乙醇体积分数的增大而增加,到50%时达到峰值,随着体积分数增大,提取量随之减少。由此可得,最适乙醇体积分数应为50%左右。
3.3. 提取的最佳时间
按照(2)的设计,实验结果见图3。通过实验可知,随着提取时间的增加,提取量也会随之增长,当提取时间到达60 min左右时,提取效果达到最大,之后随着提取时间的延长,提取效果没有太大变化,由此可得,提取的最佳时间应为60 min。
3.4. 最佳提取温度
按照(3)的设计,实验结果见图4。通过实验可知,随着提取温度的升高,提取量也会随之增长,当提取温度为50℃左右时,提取效果达到最大,之后随着提取温度继续升高时,提取效果会降低,由此可得,提取的最佳温度应为50℃。
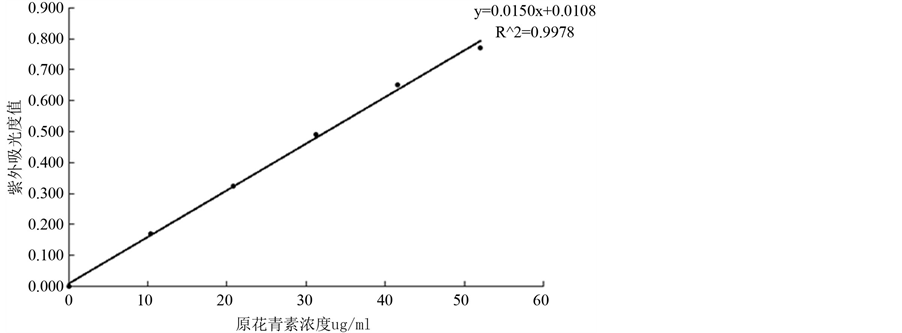
Figure 1. Standard curve of proanthocyanidins by ethanol
图1. 乙醇测定原花青素标准曲线
3.5. 最佳料液比
按照(4)的设计,实验结果见图5。通过实验可知,在设定料液比的范围内,1:5 (0.5 mg:5 mL)时,原花青素的提取量最高,可确定适宜料液比为1:5 (0.5 mg:5 mL)。
4. 讨论
有机溶剂萃取法提取葡萄皮中原花青素相比超声波提取法、超临界提取法、有机溶剂萃取法以及酶
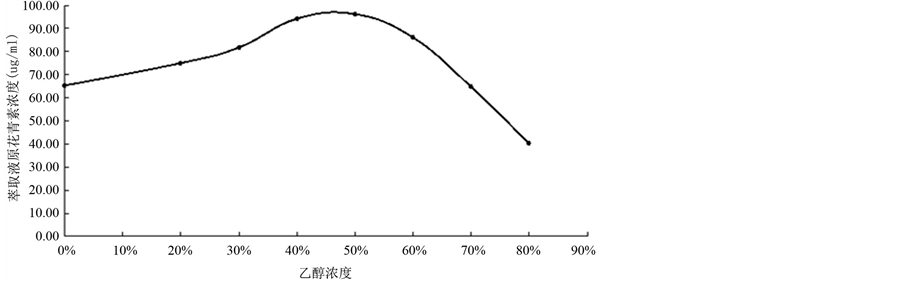
Figure 2. Effect of ethanol concentration on extraction of Proanthocyanidins at 50˚C
图2. 50℃时乙醇体积分数对提取原花青素浓度的影响
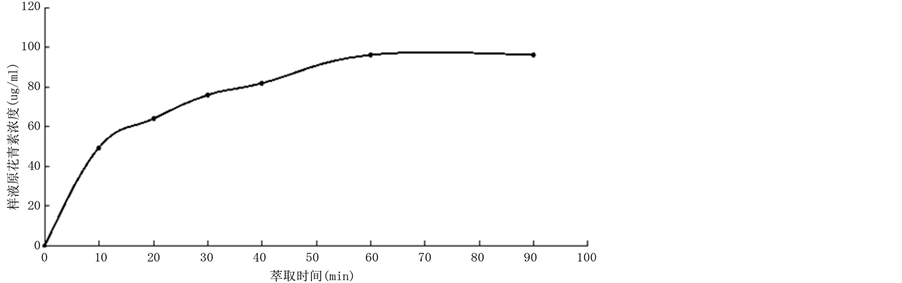
Figure 3. Effect of extraction time on extraction of Proanthocyanidins when ethanol concentration is 50% at 50˚C
图3. 50℃下50%乙醇溶液提取时间对原花青素提取浓度的影响
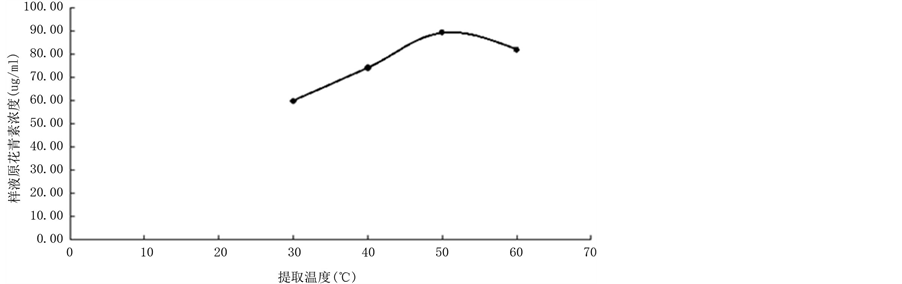
Figure 4. Effect of extraction temperature on extraction of Proanthocyanidins
图4. 提取温度对提取原花青素浓度的影响

Figure 5. Effect of ratio of solid to liquid on extraction of Proanthocyanidins
图5. 料液比对提取原花青素浓度的影响
提取法,具有操作简单、成本较低,规模可放大化以及限制因素少的优势。实验采用乙醇作为萃取剂,来源广泛,无毒性,实验原料葡萄皮廉价易得,具有可行性。
实验过程中,乙醇溶液的浓度在体积分数为50%之前,原花青素的提取量值随着乙醇体积分数的增大而增加,当到50%时达到峰值,之后则随着体积分数增大,提取量反而随之减少。这是由于不同乙醇浓度,会影响原花青素在萃取剂中的溶解度。由此可得,最适宜乙醇体积分数应为50%左右。
改变提取时间过程中,随着提取时间的增加,原花青素提取量也会随之增长,当提取时间到达60 min左右时,提取效果达到最大,之后随着提取时间的延长,提取效果没有太大变化,这是由于葡萄皮中的原花青素已经接近提尽,在萃取剂中已经达到饱和,由此可得,提取的最最适宜时间应为60 min。
改变温度的实验过程中,随着提取温度的升高,原花青素的提取量也会随之增长,当提取温度为50℃左右时,提取效果达到最大,之后随着提取温度继续升高时,提取效果会降低,这是由于在最适温度前后,都会影响原花青素在萃取剂中的溶解度,而且高温也会引起原花青素的热分解。由此可得,提取的最佳温度应为50℃。
在探究料液比的实验过程中,在设定料液比的范围内,当料液比值为1:5 (0.5 mg:5 mL)时,原花青素的提取量达到最高,这是由于料液比过低时,底物材料较少,原花青素含量少,提取效果不明显,耗费大,不划算,料液比过高时,葡萄皮利用率较低。由此则确定1:5 (0.5 mg:5 mL)为适宜的料液比。
5. 结论
本研究采用乙醇提取“巨峰”葡萄皮中的原花青素,并用紫外分光光度法测定其含量。通过绘制原花青素标准曲线以及拟合回归曲线方程,采用单因素实验探究了乙醇浓度、提取温度、提取时间以及料液比对提取效果的影响,原花青素实验提取量由标准曲线回归方程求出。实验结果表明,各因素的适宜条件为:提取乙醇的浓度为50%,提取最适温度为50℃,提取时间为60 min,最佳料液比为1:5 (0.25 mg:5 mL)。实验结果为正交试验及扩大生产奠定了基础,有利于葡萄皮资源的综合开发,对原花青素的提取工艺有一定的指导作用。
文章引用
唐 智,骆晓沛,徐立昕,曹艳丽,赫楠楠,张婧蕾. 乙醇提取“巨峰”葡萄皮中的原花青素的工艺条件探究
To Explore the Process Conditions of Extracting Proanthocyanidins from “JuFeng” Grape Skin by Ethanol[J]. 食品与营养科学, 2015, 04(04): 137-143. http://dx.doi.org/10.12677/HJFNS.2015.44019
参考文献 (References)
- 1. 傅武胜, 赵道辉, 黄剑锋. 紫外分光光度法测定葡萄籽提取物中的原花青素含量[J]. 食品研究与开发, 2002, 23(6): 90-92.
- 2. Falleh, H., Oueslati, S., Guyol, S., et al. (2011) LC/ESI-MS/MS Characterisation of Procyanidins and Properlargonidins Responsible for the Strong Antioxidant Activity of the Edible Halophyte Mesembryanthemum edule L. Food Chemistry, 127, 1732-1738. http://dx.doi.org/10.1016/j.foodchem.2011.02.049
- 3. Hamauzu, Y. and Mizuno, Y. (2011) Non-Extractable Procyanidins and Lignin Are Important Factors in the Bile Acid Binding and Radical Scavenging Properties of Cell Wall Material in Some Fruits. Plant Foods for Human Nutrition, 66, 70-77. http://dx.doi.org/10.1007/s11130-010-0207-z
- 4. 杨晓辉, 汪岭. 紫外分光光度法分析测定“黑美人”土豆原花青素[J]. 安徽农业科学, 2010, 38(25): 13643-13644.
- 5. 张寒俊, 汪海波, 习羽. 改进香草醛法测定葡萄提取物中的原花青素[J]. 中国酿造, 2010(8): 147-149.
- 6. 张瑜, 张换换, 李志洲. 红毛丹果皮中原花青素提取及其抗氧化性[J]. 食品研究与开发, 2011, 32(1): 188-192.
- 7. 李晓静, 赵国欣. 原花青素的分析方法概述[J]. 安徽农业科学, 2011, 39(1): 125-126.
- 8. 张星和. 原花青素含量检测的概述[J]. 科技致富向导, 2014(8): 267.
- 9. 马亚军, 郎慧云. 原子吸收法间接测定葡萄籽提取物中的原花青素[J]. 分析实验室, 2004, 23(9): 55-57.
- 10. 冯建光, 陈利琼. 葡萄籽提取物中OPC的测定[J]. 中国食品添加剂, 2007(4): 156-159.
- 11. 吴艳艳, 侯冬岩, 回瑞华. 铁观音茶和茶茎原花青素含量的测定[J]. 鞍山师范学院学报. 2012, 14(2): 30-33.
- 12. 陈晨, 文怀秀, 赵晓辉, 邵赟, 陶艳铎, 梅丽娟. 黑果枸杞色素中原花青素含量测定[J]. 光谱实验室, 2011, 28(4): 1767-1769.
- 13. 田琳, 孔繁东, 刘兆芳, 王雁鸣. 短梗刺五加籽原花青素的提取工艺[J]. 中国调味品, 2014(5): 102-104.
- 14. 周秋枝, 黄蕾, 沈丹华, 张滨, 栗登权, 曾丹, 鄢又玉. 火棘果中原花青素含量测定方法的建立[J]. 食品工业科技, 2013, 34(7): 314-318.
- 15. 杨志娟, 曾真, 吴晓萍. 火龙果皮原花青素提取纯化及定性分析[J]. 食品科学, 2015, 36(2): 75-79.
- 16. 梁华正, 刘成佐, 唐伯辰, 李媛, 廖晓峰. 太空莲叶原花青素的提取及分离纯化[J]. 食品科技, 2014, 39(1): 198- 203.
- 17. 张海晖, 李金凤, 段玉清, 马海乐, 徐菲菲, 秦宇. 板栗壳原花青素提取及其稳定性研究[J]. 食品科学, 2011, 32(8): 5-9.