Journal of Advances in Physical Chemistry
Vol.05 No.04(2016), Article ID:19014,9
pages
10.12677/JAPC.2016.54014
Progress in Synthesis of Porphyrin Derivatives and Its Application
Yibing Hu1, Rui Ding2, Zhijian Ding2, Jiangbo Huang1, Hongjian Peng3*
1Hunan Academy of Chinese Medicine, Changsha Hunan
2Guilin Huiang Biopharmaceutical Co., Ltd, Guilin Guangxi
3School of Chemistry and Chemical Engineering, Central South University, Changsha Hunan

Received: Nov. 2nd, 2016; accepted: Nov. 20th, 2016; published: Nov. 23rd, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Porphyrin derivatives have a very wide-range application in the clinical medicine, materials science and biology and other fields because it has good spectroscopic property and electrochemical performance due to its conjugate plane structure. Its research and development have become increasingly active, attracting more and more attention. In this paper, the present status and progress of the synthesis and application of porphyrin derivatives are reviewed, and the direction is pointed out for the synthesis and designation of porphyrin derivatives.
Keywords:Porphyrin Derivative, Synthesis, Application

卟啉类衍生物合成与应用的研究进展
胡薏冰1,丁睿2,丁志坚2,黄江波1,彭红建3*
1湖南省中医药研究院,湖南 长沙
2桂林晖昂生化药业有限责任公司,广西 桂林
3中南大学化学化工学院,湖南 长沙

收稿日期:2016年11月2日;录用日期:2016年11月20日;发布日期:2016年11月23日

摘 要
卟啉类衍生物由于共轭平面结构具有良好的光谱学性能和电化学性能,在临床医学、材料科学及生物学等诸多领域有着异常广泛的应用,其研究与开发日益活跃,引起越来越多科学工作者的关注。本文综述了卟啉类衍生物的合成与应用的研究现状和进展,并为今后卟啉类衍生物合成与设计指明了方向。
关键词 :卟啉类衍生物,合成,应用

1. 引言
卟啉是一类由4个吡咯环通过次甲基相连形成的共轭骨架大环化合物,分子结构中4个吡咯环的8个β位和4个中位(meso)的氢原子均可被其它基团所取代,生成各种卟啉衍生物。卟啉类衍生物具有良好的光谱学性能和电化学性能,其优良性能主要体现在不仅电化学性能具有一定的特殊性,而且其最大荧光发射波长位于红色发光区,能够发射出具有较大强度且稳定的红色光。因此,卟啉衍生物在荧光化学传感器、有机薄膜电致发光器、发光材料、光催化以及光动力治疗等诸多领域有重要的应用价值 [1] [2] [3] [4] 。关于卟啉类化合物的合成,在20世纪中期以前主要合成的是天然卟啉的类似物;经过多年来的深入研究,特别是近年来由于合成技术和分离技术的发展,卟啉衍生物的合成研究有了较大的进展,人们不仅设计合成了大量结构新颖的卟啉衍生物或者它们的中间体,还在研究的过程中发现了一些新的合成方法 [5] 。目前,由于光动力治疗法的迅猛发展,卟啉类衍生物已成为医药创制研究中的令人关注的焦点之一,本文综述了卟啉类衍生物的合成与应用的研究现状和进展。
2. 传统合成方法
2.1. Rothemund法
1935年,Rothemund提出了一种合成卟啉衍生物的方法,称为Rothemund法,反应原理如图1所示 [6] 。反应是在玻璃管中放置芳香族醛类(苯甲醛或者其衍生物)与吡咯的反应物及吡啶和甲醇的混合溶液,然后密封,水浴将温度升高至
Rothemund法不足的是产物的产率相当低;反应条件苛刻;后处理步骤多,繁琐;反应在密闭体系中进行,要求高。所以一般不采用Rothemund法来合成卟啉类化合物。
2.2. [2 + 2]法
1960年,MacDonald等 [7] 用醛和吡咯先合成二吡咯甲烷,然后再将两分子的二吡咯甲烷缩合氧化得卟啉化合物,所以称为[2 + 2]法,其基本实验原理如图2所示。以摩尔比为1:1的α,α'-二甲酰基二吡咯甲
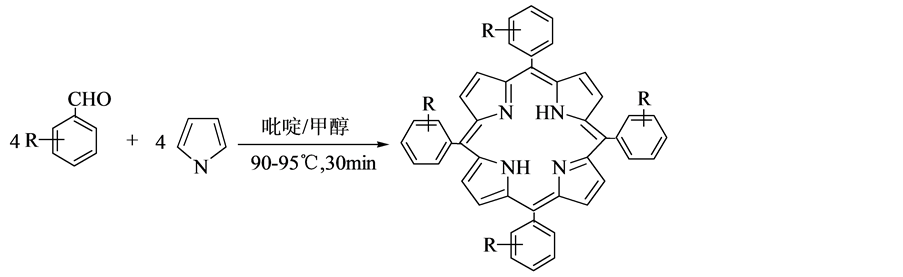
Figure 1. The method of Rothemund
图1. Rothemund法
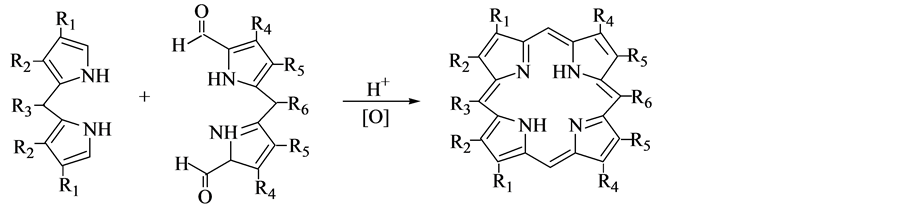
Figure 2. The method of [2 + 2]
图2. [2 + 2]法
烷与二吡咯甲烷(DPM),酸为催化剂,先合成尿卟啉。酸易使DPM发生裂解反应,将有吡咯分子脱离出去,吡咯分子间易发生缩合,从而造成分离很困难,但必须使用酸作为催化剂才能使反应进行。后来,虽然有人对[2 + 2]法作了改进:采用吡咯作为反应的单一起始原料,首先合成α-位有羟基修饰的DPM,然后再以DPM为反应物进行缩合反应,即可得到结构对称的卟啉衍生物。这样避免了DPM的裂解,但实验步骤变得繁琐,产率也不高。当连有不同取代基的DPM合成出来,再让它们分别缩合,这样可以合成在邻位和β-位连有不同取代基的卟啉类化合物,因此,[2 + 2]法合成卟啉衍生物时,在选择性和灵活性上具有很大的优势。
2.3. Adler法
1967年,Adler等 [8] 提出了一种改进卟啉衍生物的合成方法。反应流程如图3所示。首先将丙酸加热至回流,分别逐滴滴加苯甲醛和重蒸吡咯到丙酸溶液中,滴加完毕之后,在此条件下继续反应0.5 h,停止,然后将反应液冷却至室温,过滤,用热水及甲醇分别反复冲洗滤渣,最后将其真空干燥,干燥后的产物为蓝紫色,产率可达15%。Adler法合成卟啉类化合物的优点是操作简单;产率较高;原料范围来源广,可以是苯甲醛或者苯甲醛的不同取代物,因此可合成多种不同的卟啉类化合物。
2.4. [3 + 1]法
1971年,Grigg等 [9] 提出了[3 + 1]法,将一分子α,α'-二甲酰基二吡咯和一分子有饱和碳相连的胆色素环合,合成了21-氧代卟啉、硫代卟啉等卟啉类似物。后来Momenreau等 [10] 对Grigg法进行了改进,他们先合成出对称的胆色素和吡咯,得到了唯一的缩合产物。而Senge [11] 设计用各一分子的胆色素和吡咯与两分子的脂肪醛(或芳香醛)进行类似搭积木一样的缩合反应,如图4所示,合成了5,10-二取代卟啉,但这方法合成卟啉衍生物的产率并不高。Lash [12] 因此提出了另外一种合成方法,以酸作为反应的
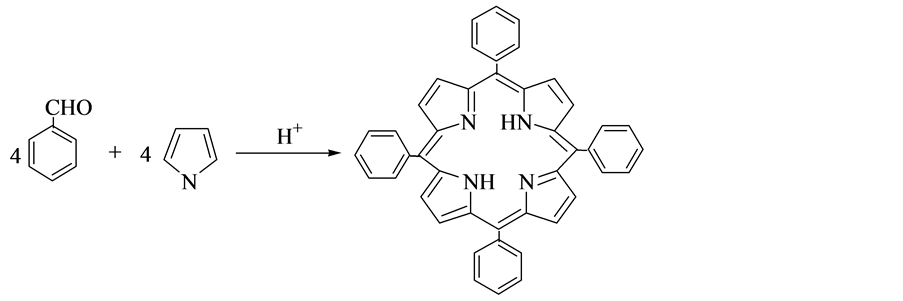
Figure 3. The method of Alde
图3. Alder法
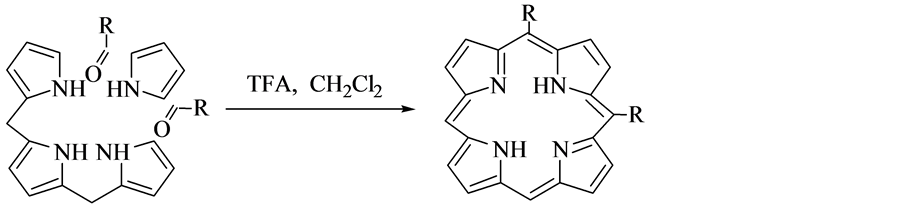
Figure 4. The method of [3 + 1]
图4. [3 + 1]法
催化剂,先用吡咯二醛与胆色素进行缩合反应,合成得到卟啉原,然后再用DDQ对卟啉原做氧化处理,得到八烷基卟啉,该方法的产率可达60%。因[3 + 1]法只有在胆色素被成功合成的条件下才能进行,所以总产率一般较低。但如果想要合成一些结构复杂的卟啉类化合物,[3 + 1]法还是有很大的应用价值的。此外,还可将[3 + 1]法应用到一些由芳香环合成扩展的卟啉或类卟啉化合物。
2.5. Lindsey法
1986年,Lindsey等 [13] [14] 提出了合成卟啉化合物的一种新方法,反应分两步进行,其反应原理如图5所示。其操作流程如下:以三氟化硼和乙醚的混合液为催化剂,以二氯甲烷为反应溶剂,反应在氮气气氛中,苯甲醛和吡咯反应先生成卟啉衍生物中间体卟啉原(porphyrinogen),该中间体已由Dolphin等 [15] 证实;然后选取四氯苯醌或者二氯二腈基苯醌作为氧化剂,氧化卟啉原,四苯基卟啉即为卟啉原氧化后的产物。Lindsey两步合成法的最大优势是将反应温度控制在室温,这样使高温条件下的焦油状副产物不易生成,从而简化了对目标产物的分离、提纯等操作;在温和的反应条件下,一些敏感的基团的连接可以通过化学修饰实现。
Lindsey两步合成法存在一些不足:反应一定要控制在无水的条件;使用的有机试剂价格比较昂贵;反应时试剂的浓度不可过高,只能为10−2 mol/L,因此,卟啉类化合物的产业化受到限制。
3. 现代合成方法
针对卟啉衍生物的传统合成方法存在一些不足,如反应时间较长、发生副反应的几率大、反应产物具有较低的产率、提纯反应产物比较困难等,这在一定程度上阻碍了卟啉衍生物合成及应用的发展。Gedye等人 [16] 发现,在有机合成过程中采用微波辐射会使反应的速率提高许多,因此微波辐射在合成化学领域
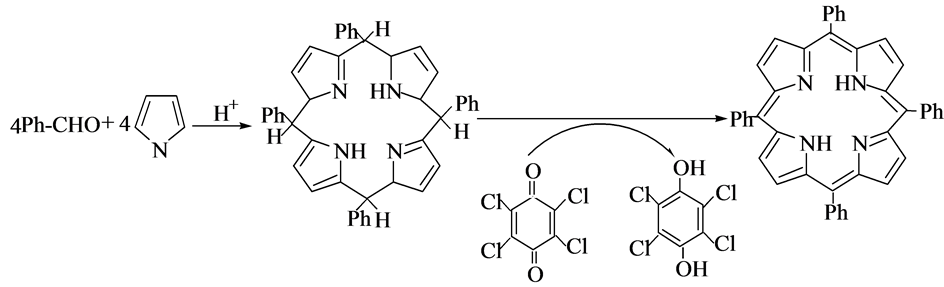
Figure 5. The method of Lindsey
图5. Lindsey法
中的应用日益广泛。
1992年,法国的化学家Petit [17] 提出了一种卟啉衍生物的新合成方法:将按摩尔比的吡咯与苯甲醛的混合溶液吸附于酸性的无机硅胶载体之上,酸性的无机硅胶载体具有催化作用,采用微波辐射合成了卟啉类化合物,产率为9.5%。此后胡希明等人 [18] 改进了合成方法,将卟啉类化合物的产率提高到13%。刘云等人 [19] 以二甲苯作为反应溶剂,硝基苯甲醛为反应的催化剂,将苯甲醛与吡咯放置在微波内,在微波辐射下反应20 min,合成了卟啉衍生物,产率为42%。2009年,黄兴强等人 [20] 以有机酸为催化剂,采用微波辐射合成四(对硝基苯基)卟啉,产率达到23.9%,符合节能环保、绿色化工的发展趋势。2010年,Benjamin Boens等人 [21] 以碘单质做催化剂、二氯甲烷做溶剂,加上微波辐射,合成了单硝基取代的四苯基卟啉及四苯基卟啉,产率分别为22%和47%。
2013年,陈创等人 [22] 采用微波加热合成法,以对氰基苯甲醛、苯甲醛和吡咯为原料,丙酸为溶剂和催化剂合成了一系列含氰基的卟啉化合物,具体路线如图6所示,产率可达17%。还有,陈年友等人 [23] 采用微波辐射方法,合成了一种新型的卟啉–蒽醌二元化合物,具体合成方法如图7所示,产率可达40%。
2014年,孙福强等人 [24] 采用微波辅助合成5-[4-(4-溴代丁氧基)苯基]-10,15,20-三对甲氧基苯基卟啉,具体方法如图8所示。在90℃、DMF 溶剂条件下微波辐射加热30 min,快速高效得到目标化合物,反应产率89.2%。因此在合成的过程中加入微波辐射的方法不仅简化了反应,同时也在很大程度上提高了反应的速率,使反应时间大大缩短,也减小了副反应发生的概率,给后处理带来了一定的方便。
4. 卟啉衍生物的应用
4.1. 在医学上的应用
近年来,随着光动力治疗方法(PDT)在临床上的广泛应用 [25] [26] [27] [28] [29] ,特别对于恶性肿瘤的疗效显著,因此PDT发展迅猛。PDT最大的优点是能够对肿瘤组织进行定向消除,而不对机体的其他正常组织造成影响。卟啉类化合物是一种具有良好性能的光敏剂,在有氧存在的环境下,如果被拥有特定波长的光照射就会通过吸收光能发射出单线态氧,并将癌细胞杀死。利用卟啉类化合物的特性,先通过注射让其在癌变部位聚集,再利用特定波段的光或者激光对癌变部位进行照射,将癌细胞杀死,达到治疗的目的。在光动力疗法领域中,血卟啉衍生物(HpD)是最早被应用的卟啉衍生物,血卟啉衍生物的用途也很广泛,不仅能使肺癌患病者的某些症状得到缓解,而且还能使一些肺癌早期的患者得到完全治愈。最近,桂林晖昂生化药业有限责任公司合成了一种完全水溶性的光敏剂单体——卟啉衍生物 [30] ,药理实验表明,该衍生物采用PDT对实体瘤、癌前病变等具有非常好的疗效,有望成为新一代PDT治疗药物。

Figure 6. Microwave synthesis of cyano-porphyrin
图6. 氰基卟啉的微波合成

Figure 7. Microware synthesis of a novel porphyrin-anthraquinone
图7. 新型卟啉-蒽醌的微波合成
4.2. 在材料科学上的应用
卟啉类化合物由于其共轭结构具有良好的荧光性能,在650 nm的波长呈现出红色的光,并且强度较大,因此人们常会将卟啉衍生物用于某些有机电致发光器件的制作中 [31] ,一般是选取卟啉衍生物作为
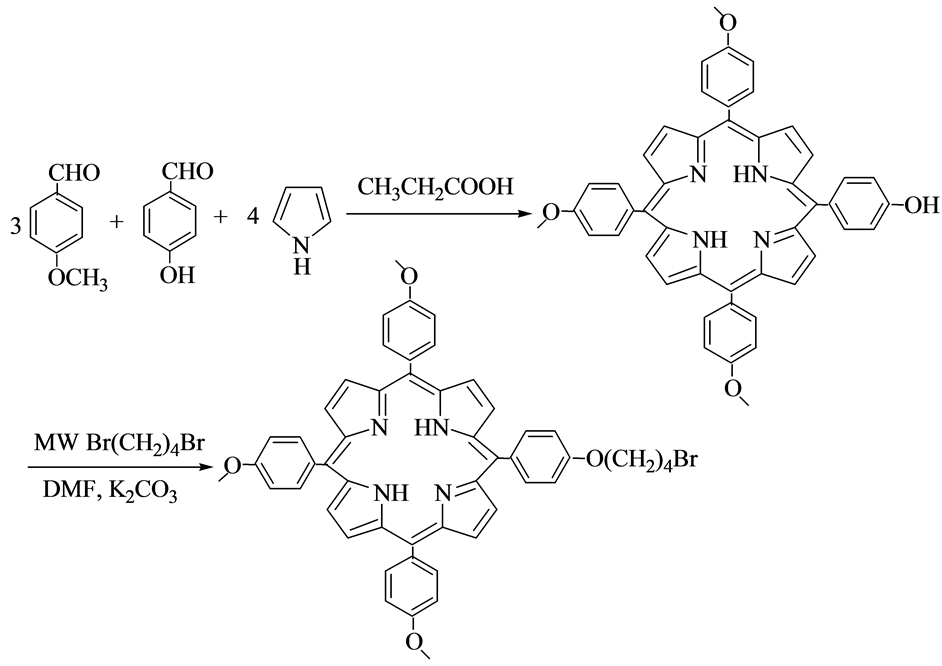
Figure 8. Microwave synthesis of 5-[4-(4-bromobutoxy)phenyl]-10,15,20-tri-methoxyphenyporphyrin
图8. 5-[4-(4-溴代丁氧基)苯基]-10,15,20-三对甲氧基苯基卟啉的微波合成
红色光的掺杂染料。迄今为止,作为红光掺杂染料已经被广泛应用的卟啉类化合物有PtOEP (八乙基卟啉铂) [32] 、TBDPP (二叔丁基苯基卟啉) [33] 、TPPH2 (四苯基卟啉) [34] 、TPC (还原四苯基卟啉) [35] 等。除此之外,在分子水平的光电器件、光能的存储、太阳能电池等位于应用前沿的领域也研究较多 [36] [37] 。
4.3. 在生物学上的应用
卟啉是叶绿素、细胞色素和血红素等生物大分子的母体,卟啉的金属配合物作为主体分子具有独特的优势:卟啉环具有刚性的平面结构,可以很好的控制官能团的位置和方向,使其与客体分子之间有最好的相互作用;还有,卟啉分子的大环结构使其具有较大的表面,对金属卟啉分子轴向配体周围的相互作用方向和空间容积能较好的控制;另外,金属卟啉配合物的多样性,因此金属卟啉配合物可对多种有机分子和生物分子进行识别 [38] 。卟啉金属配合物还可以应用于DNA的定向切割,有望从分子层面上设计出高性能的核酸定位断裂剂,这不对癌症的基因治疗、基因免疫印迹分析、大片段基因的分子识别等都具有重要意义 [39] 。
5. 展望
综上所述,随着人类日益增长的研发及医药需求,大量的卟啉衍生物被设计合成并应用,衍生物的合成设计与结构修饰得到了越来越多的关注。特别是光动力治疗的广泛应用,作为光敏剂的卟啉化合物的合成与结构的关系还亟待进一步加强,卟啉的化学结构与PDT效能的关系;合成各种基团修饰的卟啉类化合物,使其高效低毒,渗透性、吸收性及代谢等方面的特性都得到加强;卟啉类衍生物绿色制备、分离纯化等过程的产业化。随着研究工作的不断深入,具有高疗效的卟啉类化合物必将设计合成,且应用范围更加广泛。
基金项目
桂林晖昂生化药业有限责任公司资助项目(20150207)。
文章引用
胡薏冰,丁 睿,丁志坚,黄江波,彭红建. 卟啉类衍生物合成与应用的研究进展
Progress in Synthesis of Porphyrin Derivatives and Its Application[J]. 物理化学进展, 2016, 05(04): 122-130. http://dx.doi.org/10.12677/JAPC.2016.54014
参考文献 (References)
- 1. Watanabe, E., Nishimura, S., Ogoshi, H., et al. (1975) Orientation of Electrophilic Meso-Substitution in Metallooctaethylporphyrins. Tetrahedron, 31, 1385-1390. https://doi.org/10.1016/0040-4020(75)87068-2
- 2. Hoffmann, M.R., Martin, S.T., Choi, W.Y., et al. (1995) Environmental Applications of Semiconductor Photocatalysis. Chemical Reviews, 95, 69-96. https://doi.org/10.1021/cr00033a004
- 3. Zhou, X., Tse, M.K., Wan, T.S.M., et al. (1996) Synthesis of Beta-Mono-, Tetra-, and Octa-Substituted Sterically Bulky Porphyrins via Suzuki cross Coupling. Journal of Organic Chemistry, 61, 3590-3593. https://doi.org/10.1021/jo952205+
- 4. Sedghi, G., Sawada, K., Esdaile, L.J., et al. (2008) Single Molecule Conductance of Porphyrin Wires with Ultralow Attenuation. Journal of the American Chemical Society, 130, 8582-8583. https://doi.org/10.1021/ja802281c
- 5. Liu, X.-G., Feng, Y.-Q., Chen, X., et al. (2005) Porphyrins as Dipolarophiles in 1, 3-Dipolar Cycloaddition Reactions with Nitrile Oxide. SYNLETT, 6, 1030-1032.
- 6. Rothemund, P. (1939) Porphyrin Studies III: The Structure of the Porphine Ring System. Journal of the American Chemical Society, 61, 2912-2915. https://doi.org/10.1021/ja01265a096
- 7. Arsenault, G.P., Bullock, E. and MacDonald, S.F. (1960) Pyrromethanes and Porphyrins Therefrom. Journal of the American Chemical Society, 82, 4384-4389. https://doi.org/10.1021/ja01501a066
- 8. Adler, A.D., Longo, F.R., John, D.F., et al. (1967) A Simplified Synthesis for Meso-Tetraphenylporphine. Journal of Organic Chemistry, 32, 476-476. https://doi.org/10.1021/jo01288a053
- 9. Broadhurst, M.J., Grigg, R. and Johnson, A.W. (1971) Synthesis of Porphyrin Analogues Containing Furan and or Thiophen Rings. Journal of the American Chemical Society, 95, 3681-3690.
- 10. Boudif, A. and Momenteau, M. (1996) A New Convergent Method for Porphyrin Synthesis Based on a “3 + 1” Condensation. Journal of the Chemical Society, Perkin Transactions, 1, 1235-1242. https://doi.org/10.1039/P19960001235
- 11. Senge, M.O. (2003) Synthetic Access to 5,10-Disubstituted Porphyrins. Tetrahedron Letters, 44, 157-160. https://doi.org/10.1016/S0040-4039(02)02475-9
- 12. Lash, T.D. (1997) Porphyrins with Exocyclic Rings. Part 9 Synthesis of Porphyrins by the “3+1” Approach. Journal of Porphyrins and Phthalocyanines, 1, 29-44. https://doi.org/10.1002/(SICI)1099-1409(199701)1:1<29::AID-JPP7>3.0.CO;2-S
- 13. Lindsey, J.S, Schreiman, I.C., Hsu, H.C. et al. (1987) Rothemund and Adler-Longo Reactions Revisited Synthesis of Tetraphenylporphyrins under Equilibrium Conditions. Journal of Organic Chemistry, 52, 827-836. https://doi.org/10.1021/jo00381a022
- 14. Montanari, F. and Casella, L. (1994) Metalloporphyrins Catalyzed Oxidations. Springer, Berlin. https://doi.org/10.1007/978-94-017-2247-6
- 15. Dolphin, D. (1970) Porphyrinogens and Porphodimrthenes, Intermediates in the Synthesis of Meso-Tetraphenyl Porphins from Pyrroles and Benzaldehyde. Journal of Heterocyclic Chemistry, 7, 275-282. https://doi.org/10.1002/jhet.5570070205
- 16. Gedye, R., Smith, F. and Westaway, K. (1986) The Use of Microwave Ovens for Rapid Organic Synthesis. Tetrahedron Letters, 27, 279-282. https://doi.org/10.1016/S0040-4039(00)83996-9
- 17. Petit, A., Loupy, A., Maillard, P., et al. (1992) Microwave Irradiation in Dry Media: A New and Easy Method for Synthesis of Tetrapyrrolic Compounds. Synthetic Communications, 22, 1137-1142. https://doi.org/10.1080/00397919208021097
- 18. 胡希明, 梅治乾, 刘海洋, 等. 四苯基卟啉的微波诱导合成研究[J]. 华南理工大学学报(自然科学版), 1999, 27(10): 11-15.
- 19. 刘云, 徐同宽, 肖德宝, 等. 四苯基卟啉的催化合成和微波合成研究[J]. 北京轻工业学院学报, 1998, 16(4): 37- 44.
- 20. 黄兴强, 樊艳玲, 吴天骄, 吴腊梅, 陈连清. 微波辐射下催化合成四(对硝基苯基)卟啉[J]. 江西师范大学学报(自然科学版), 2009, 33(6): 721-724.
- 21. Benjamin, B., Faugeras, P.A., Vergnaud, J., et al. (2010) Iodine-Catalyzed One-Pot Synthesis of Unsymmetrical Meso- Substituted Porphyrins, Tetrahedron, 66, 1994-1996. https://doi.org/10.1016/j.tet.2010.01.055
- 22. 陈创, 徐扬, 胡芸, 吴璟, 陈金阳, 等. 系列氰基卟啉化合物的微波合成及表征[J]. 广州化工, 2013, 41(14): 70- 71.
- 23. 陈年友, 赵胜芳, 陈国安. 一种新型卟啉-蒽醌化合物的微波合成及其光诱导电子转移性质[J]. 化学试剂, 2013, 35(1): 24-26.
- 24. 孙福强, 梅文杰, 崔英德. 微波辅助合成5-[4-(4-溴代丁氧基)苯基]-10,15,20-三对甲氧基苯基卟啉[J]. 化工进展, 2014, 33(5): 1296-1299.
- 25. Hasrat, A. and Johan, E.V. (1999) Metal Complexes as Photo- and Radiosensitizers. Chemical Reviews, 99, 2379-2450. https://doi.org/10.1021/cr980439y
- 26. Comuzzi, C., Cogoi, S., Overhand, M., et al. (2006) Synthesis and Biological Evaluation of New Pentaphyrin Macrocycles for Photodynamictherapy. Journal of Medicinal Chemistry, 49, 196-204. https://doi.org/10.1021/jm050831l
- 27. Desroches, M.-C., Bautista-Sanchez, A., Lamotte, C., et al. (2006) Pharmaco-kinetics of a Tri-Glucoconjugated 5, 10, 15-(Meta)-Trihydroxyphenyl-20-Phenyl Porphyrin Photosensitizer for PDT a Single Dose Study in the Rat. Journal of Photochemistry and Photobiology B: Biology, 85, 56-64. https://doi.org/10.1016/j.jphotobiol.2006.03.008
- 28. Lang, K., Mosinger, J. and Wagnerova, D.M. (2004) Photo-physical Properties of Porphyrinoid Sensitizers Non-Cova- lently Bound to Hostmolecules. Models for Photo Dynamic Therapy. Coordination Chemistry Reviews, 248, 321-350. https://doi.org/10.1016/j.ccr.2004.02.004
- 29. Dolmans, D.E.J.G.J., Fukumura, D. and Jain, R.K. (2003) Photodynamic Therapy for Cancer. Nature Reviews Cancer, 3, 380-387. https://doi.org/10.1038/nrc1071
- 30. 丁志坚, 韩臻, 周春秋, 等. 一种新型的完全水溶的光敏剂单体及其制备方法及应用[P]. 中国专利, 104086554A. 2014-10-08.
- 31. Baldo, M.A., Obrien, D.F., You, Y., et al. (1998) Highly Efficient Phosphorescent Emission from Organic Electroluminescent Devices. Nature, 395, 151-154. https://doi.org/10.1038/25954
- 32. Zhang, X.H., Xie, Z.Y., Wu, F.P., et al. (2003) Red Electroluminescence and Photolu-Minescence Properties of New Porphyrin Compounds. Chemical Physics Letters, 382, 561-566. https://doi.org/10.1016/j.cplett.2003.10.104
- 33. Burrows, P.E., Forest, S.R., Sibley, S.P., et al. (1996) Color-Tunable Organic Light-Emitting Devices. Applied Physics Letters, 69, 2959-2961. https://doi.org/10.1063/1.117743
- 34. Sakakibara, Y., Okutsu, S., Enokida, T., et al. (1999) Red Organic Electroluminescence Devices with a Reduced Porphyrin Compound, Tetraphenylchlorin. Applied Physics Letters, 74, 2587-2589. https://doi.org/10.1063/1.123906
- 35. Rault, B.J., Paul, R.C., Simonneaux, G.J. (2008) Comparative Be-haviour of the Anodic Oxidation of Mono-, Di- and Tetra-Arylporphyrins: Towards New Electroactive Materials with Variable Bandgaps. Electroanalytical Chemistry, 623, 204-214. https://doi.org/10.1016/j.jelechem.2008.07.013
- 36. 徐海云, 胡春华, 冯翠兰. 卟啉类有机化合物在染料敏化太阳能电池的应用研究进展[J]. 应用化工, 2011, 40(8): 1451-1457.
- 37. 张天慧, 朴玲钰, 赵谡玲, 等. 有机太阳能电池材料研究新进展[J]. 有机化学, 2011, 31(2): 260-272.
- 38. Deviprasad, G.R. and D’Souza, F. (2000) Molecular Recognition Directed Porphyrin Chemosensor for Selective Detection of Nicotine and Cotinine. Chemical Communications, 19, 1915-1916. https://doi.org/10.1039/b006055k
- 39. Armitage, B. (1998) Photocleavage of Nucleic Acids. Chemical Reviews, 98, 1171-1200. https://doi.org/10.1021/cr960428+
NOTES
*通讯作者。