 Advances In Analytical Chemistry 分析化学进展, 2012, 2, 7-13 http://dx.doi.org/10.12677/aac.2012.22002 Published Online May 2012 (http://www.hanspub.org/journal/aac) Inclusion Complex of Malachite Green with Cucurbit[7]uril and Detection of Malachite Green Using Cucurbit[7]uril Dongbao Tang, Junyong Sun, Kai Wu, Tao Li, Yu nyou Zhou Anhui Key Laboratory of Chemo-Biosensing, College of Chemistry and Materials Science, Anhui Normal University, Wuhu Email: zy161299@mail.ahnu.edu.cn Received: Mar. 30th, 2012; revised: Apr. 25th, 2012; accepted: May 15th, 2012 Abstract: The interaction between malachite green (MG) and cucurbit[7]uril (CB7) had been studied based on fluores- cence and 1H NMR spectroscopic results. The interaction mechanism was also discussed concretely based on 1H NMR results. The fluorescence intensity of malachite green (MG) enhanced strongly and a slight red shift was observed at the maximum emission peak when added into cucurbit[7]uril. We had found that the formation of the complex at a 1:1 complex stoichiometry and the association constant was calculated by applying a deduced equation. The thermody- namic parameters such as ΔH and ΔS values were obtained according to Van’t Hoff equation, respectively. We prepared the solid inclusion complex from co-evaporation method and characterised it by 1H NMR、IR. For the efficient detection of malachite green, the limit of detection was 4.2 × 10–8 mol·L–1 from our experiments which will make our method applied to detect the malachite green in sewage effectively. Keywords: Fluorescence; Cucurbit[7]uril; Malachite Green; Inclusion Interaction; Stability Constants of Complexation 葫芦[7]脲对孔雀石绿的包结作用及应用 唐冬宝,孙军勇,武 凯,李 涛,周运友 安徽师范大学化学与材料科学学院,芜湖 Email: zy161299@mail.ahnu.edu.cn 收稿日期:2012 年3月30 日;修回日期:2012年4月25日;录用日期:2012年5月15日 摘 要:利用荧光光谱滴定法研究孔雀石绿和葫芦[7]脲的包结作用,在一定的浓度范围内,我们发现孔雀石绿 的荧光强度随着葫芦[7]脲的浓度的增加而增加,同时,最大发射峰的位置发生了一定程度的红移。我们利用了 紫外–可见吸收光谱、荧光光谱、IR、1H NMR 和量子化学计算等方法研究了水溶液中孔雀石绿与葫芦[7]脲之间 的包结行为,探讨了MG- CB [7 ] 的包结机理。相关的结果表明孔雀石绿与葫芦[7]之间形成1:1 的包结络合物。该 方法的检出限是4.2 × 10–8 mol·L–1。 关键词:荧光;葫芦[7]脲;孔雀石绿;包结作用;稳定常数 1. 引言 孔雀石绿(MG,图 1)是一种非常重要的 N-甲基二 氨基三苯基甲烷染料,被广泛地应在毛织品、丝绸、 棉织品、皮革与纸张的染色方面,同时,它也被世界 各国广泛地运用到水产养殖业方面,主要是用来治疗 寄生虫、真菌和细菌感染的鱼和鱼卵[1-3]。但是,对于 人和动物来说,即使是在很低的浓度下,孔雀石绿是 一种毒性非常强的化合物,它可以对肝、鳃、肾、肠 和性腺造成非常严重的不利影响,在人类生活中,摄 入孔雀石绿可能会刺激肠胃,皮肤与孔雀石绿接触后 会导致发炎、发红和疼痛[4-6]。人们经常利用HPLC-MS 色谱分析法来对孔雀石绿进行检测[7-12],但是这种 Copyright © 2012 Hanspub 7  葫芦[7]脲对孔雀石绿的包结作用及应用 (a) (b) Figure 1. Structures of CB7 (a) and MG (b) 图1. CB[7] (a)和MG ( b) 的结构 方法不仅耗费很大而且灵敏度不高,因此人们很有必 要发展一种成本更低以及更加简单有效的方法来检 测水样中的孔雀石绿。 作为最新一代的主体超分子化合物,葫芦[n]脲 (CB[n],图 1)是由n个甘脲单元和亚甲基桥联结起来 形成的一个拥有刚性、高度对称的结构的葫芦状大环 化合物。它具有两端开口的空腔,空腔由羰基所环绕, 其两端口尺寸相同,空腔直径大于端口直径,因其直 径大于端口直径,外部形状特征类似于葫芦或南瓜而 得名[13-20]。 为了在水溶液中形成稳定的包结物[20],可以通过 疏水作用使得小客体分子例如有机染料进入到葫芦[n] 脲的刚性空腔里。金属离子[21]、有机染料和有机胺[20] 可以通过离子偶极作用与葫芦[n ] 脲的端口的羰基结 合。一般来说,人们经常通过非共价相互作用来探讨 葫芦[7] 脲与客体分子结合的分子特性特别是在辐射 特性与激发态动力学方面的变化。 我们报道了利用灵敏的 CB[7]荧光传感器来检测 水溶液和污水中孔雀石绿的含量。测得的孔雀石绿的 检出限是4.2 × 10–8 mol·L–1,这个结果与文献报道[7-12] 的非常接近,但是我们的方法更加便宜和方便。结果 表明孔雀石绿与浓度很低的 CB[7]结合形成 1:1的络 合物,我们计算出这种络合物的结合常数是 1.8 × 104 L·mol–1。不同温度下的热力学参数如K、ΔH、ΔS、ΔG 可以通过相关的公式计算获得,我们通过 Gaussian 03W at B3LYP/6-31G 的程序分析孔雀石绿和 CB[7]的 可能的结合机理。 2. 实验部分 2.1. 仪器 日本 Hitachi F-4500型荧光光谱仪(仪器附有恒温 池);日本 Hitachi-U3010 Spectrophotometer,Phs-3C 型精密酸度仪(上海天达仪器有限公司);Avance Bru-300 MHz型核磁共振仪(瑞士,Bruker 公司)日本 Shimadzu 8400S型傅里叶变换红外光谱仪(KBr 压片)。 2.2. 试剂 所有的试剂都是分析纯,葫芦[7]脲是按照文献 [22-24]自制的,经过 1H NMR,IR 和元素分析确证,孔 雀石绿(生化试剂,上海化学试剂公 司),整个实验过 程用水为石英亚沸水,实验使用 NaAc-HAc 缓冲溶液 调节反应体系的pH 值。 2.3. 实验方法 2.3.1. 固体 CB7-MG 络合物的制备 我们通过溶剂蒸发的方法制备出固态 CB7-MG 络合物,将 0.1824 g 的孔雀石绿溶解在 40 mL 80℃的 二次水中搅拌15 min 形成孔雀石绿的水溶液,然后我 们慢慢地将同样浓度的CB7溶液(0.581 g,溶解在二 次水中)加入到上述溶液中,将上面的混合物在 80℃ 下搅拌 6 h后减压抽滤。粗产品用丙酮洗涤两次,在 50℃下真空干燥后获得最后的产品。 2.3.2. 污水的处理 将10 mL的不纯净的水(初步的污水是用常压过 Copyright © 2012 Hanspub 8 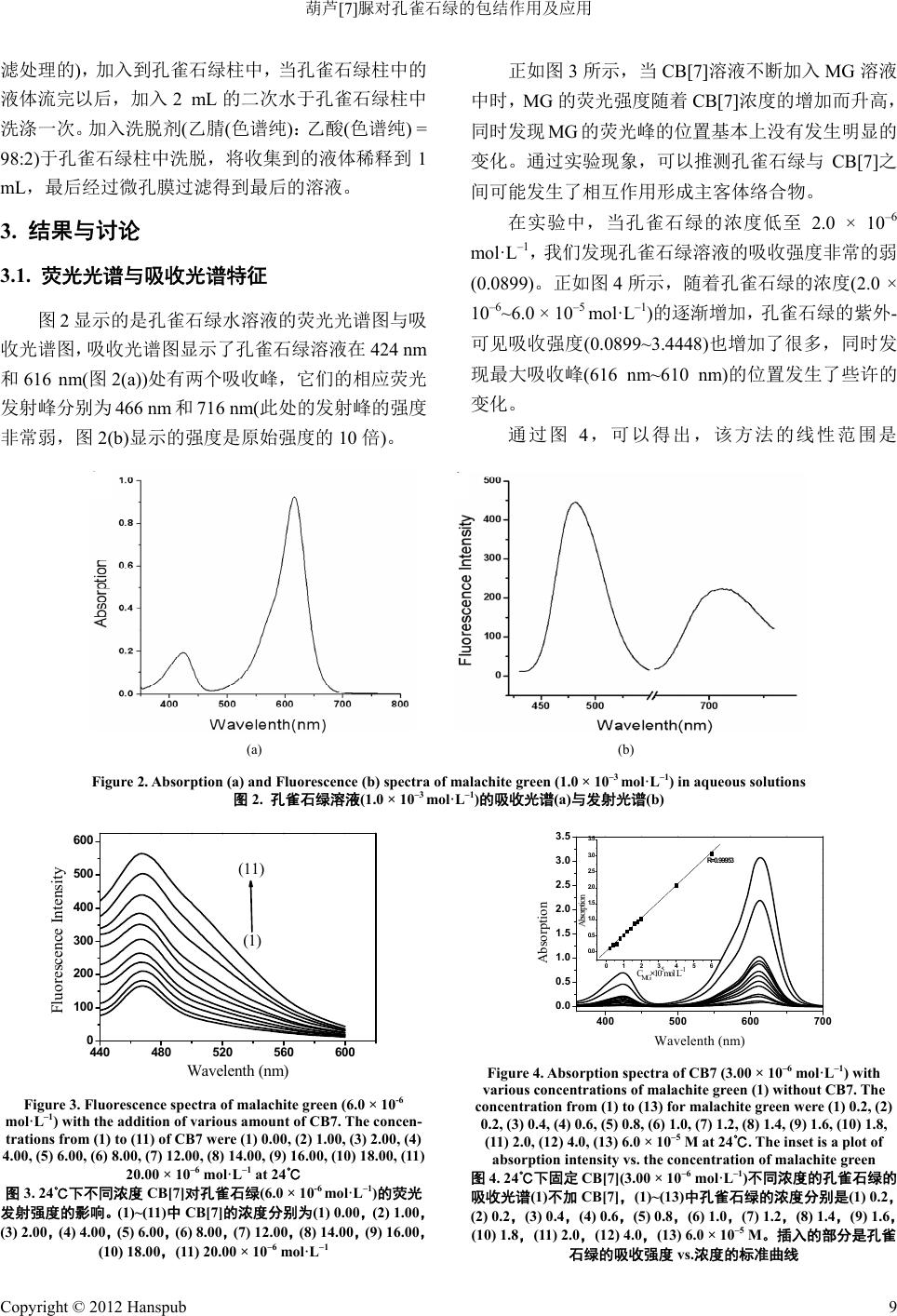 葫芦[7]脲对孔雀石绿的包结作用及应用 滤处理的),加入到孔雀石绿柱中,当孔雀石绿柱中的 液体流完以后,加入 2 mL的二次水于孔雀石绿柱中 洗涤一次。加入洗脱剂(乙腈(色谱纯):乙酸(色谱纯) = 98:2)于孔雀石绿柱中洗脱,将收集到的液体稀释到 1 mL,最后经过微孔膜过滤得到最后的溶液。 3. 结果与讨论 3.1. 荧光光谱与吸收光谱特征 图2显示的是孔雀石绿水溶液的荧光光谱图与吸 收光谱图,吸收光谱图显示了孔雀石绿溶液在 424 nm 和616 nm(图2(a))处有两个吸收峰,它们的相应荧光 发射峰分别为466 nm和716 nm(此处的发射峰的强度 非常弱,图 2(b)显示的强度是原始强度的 10 倍)。 正如图 3所示,当 CB[7]溶液不断加入 MG 溶液 中时,MG 的荧光强度随着 CB[7]浓度的增加而升高, 同时发现 MG 的荧光峰的位置基本上没有发生明显的 变化。通过实验现象,可以推测孔雀石绿与 CB[7]之 间可能发生了相互作用形成主客体络合物。 在实验中,当孔雀石绿的浓度低至 2.0 × 10–6 mol· L –1,我们发现孔雀石绿溶液的吸收强度非常的弱 (0.0899)。正如图 4所示,随着孔雀石绿的浓度(2.0 × 10–6~6.0 × 10–5 mol · L –1)的逐渐增加,孔雀石绿的紫外- 可见吸收强度(0.0899~3.4448)也增加了很多,同时发 现最大吸收峰(616 nm~610 nm)的位 置发 生了些许 的 变化。 通过图4,可以得出,该方法的线性范围是 (a) (b) Figure 2. Absorption (a ) and Fluore scence (b) spectra of malachite green (1.0 × 10–3 mol· L–1) in aqueous solutions 图2. 孔雀石绿溶液(1.0 × 10–3 mo l· L –1)的吸收光谱(a)与发射光谱(b) 440 480 520 560600 0 100 200 300 400 500 600 Fluorescence Intensity Wavelenth (nm) (1) (11) Figure 3. Fluorescence spectra of malachite g reen (6.0 × 10-6 mol·L–1) with the addition of var iou s amount of CB7. The concen- trations from (1) to (11) of CB7 were (1) 0.00, (2) 1.00, (3) 2.00, (4) 4.00, (5) 6.00, (6) 8.00, (7) 12.00, (8) 14.00, (9) 16.00, (10) 18.00, (11) 20.00 × 10–6 mol·L–1 at 24℃ 图3. 24℃下不同浓度 CB[7]对孔雀石绿(6.0 × 10-6 mol·L–1)的荧光 发射强度的影响。(1)~(11)中CB[7]的浓度分别为(1) 0.00,(2) 1.00, (3) 2.00,(4) 4.00,(5) 6.00,(6) 8.00,(7) 12.00,(8) 14.00,(9) 16.00, (10) 18.00,(11) 20.00 × 10–6 mol·L–1 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 0123456 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 R=0.99953 Abs or pt i on C MG×105 mol L-1 Absorption Wavelenth (nm) Figure 4. Absorption spectra of CB7 (3.00 × 10–6 mol·L–1) with various concentrations of malachite green (1) without CB7. The concentration from (1) to (13) for malachite green were (1) 0.2, (2) 0.2, (3) 0.4, (4) 0.6, (5) 0.8, (6) 1.0, (7) 1.2, (8) 1.4, (9) 1.6, (10) 1.8, (11) 2.0, (12) 4.0, (13) 6.0 × 10–5 M at 24℃. The inset is a plot of absorption intensity vs. the concentration of malachite green 图4. 24℃下固定 CB[7](3.00 × 10–6 mol·L–1)不同浓度的孔雀石绿的 吸收光谱(1)不加 CB[7],(1)~(13)中孔雀石绿的浓度分别是(1) 0.2, (2) 0.2,(3) 0.4,(4) 0.6,(5) 0.8,(6) 1.0,(7) 1.2,(8) 1.4,(9) 1.6, (10) 1.8,(11) 2.0,(12) 4.0,(13) 6.0 × 10–5 M。插入的部分是孔雀 石绿的吸收强度 vs.浓度的标准曲线 Copyright © 2012 Hanspub 9 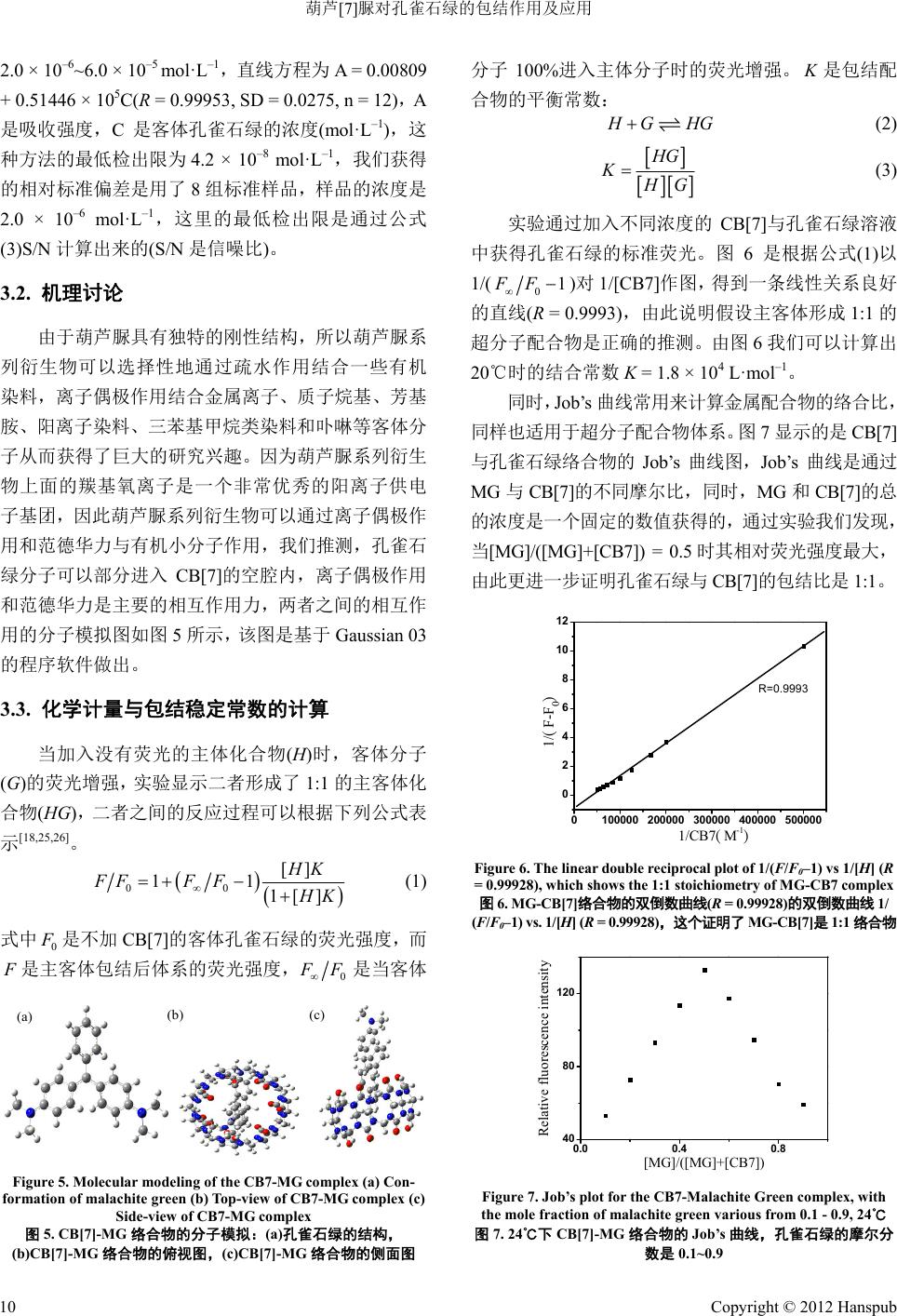 葫芦[7]脲对孔雀石绿的包结作用及应用 2.0 × 10–6~6.0 × 10–5 mol · L –1,直线方程为 A = 0.00809 + 0.51446 × 105C(R = 0.99953, SD = 0.0275, n = 12),A 是吸收强度,C是客体孔雀石绿的浓度(mol·L–1),这 种方法的最低检出限为4.2 × 10–8 mol·L–1,我们获得 的相对标准偏差是用了 8组标准样品,样品的浓度是 2.0 × 10–6 mol·L–1,这里的最低检出限是通过公式 (3)S/N 计算出来的(S/N 是信噪比)。 3.2. 机理讨论 由于葫芦脲具有独特的刚性结构,所以葫芦脲系 列衍生物可以选择性地通过疏水作用结合一些有机 染料,离子偶极作用结合金属离子、质子烷基、芳基 胺、阳离子染料、三苯基甲烷类染料和卟啉等客体分 子从而获得了巨大的研究兴趣。因为葫芦脲系列衍生 物上面的羰基氧离子是一个非常优秀的阳离子供电 子基团,因此葫芦脲系列衍生物可以通过离子偶极作 用和范德华力与有机小分子作用,我们推测,孔雀石 绿分子可以部分进入 CB[7]的空腔内,离子偶极作用 和范德华力是主要的相互作用力,两者之间的相互作 用的分子模拟图如图 5所示,该图是基于 Gaussian 03 的程序软件做出。 3.3. 化学计量与包结稳定常数的计算 当加入没有荧光的主体化合物(H)时,客体分子 (G)的荧光增强,实验显示二者形成了 1:1 的主客体化 合物(HG),二者之间的反应过程可以根据下列公式表 示[18,25,26]。 00 [] 11 1[ ] HK FFF F H K (1) 式中 0 F 是不加 CB[7]的客体孔雀石绿的荧光强度,而 F 是主客体包结后体系的荧光强度, 0 F F 是当客体 (a) (b) (c) Figure 5. Molecular modeling of the CB7-MG complex (a) Con- formation of malachite green (b) Top-view of CB7-MG complex (c) Side-view of CB7-MG complex 图5. CB[7]-MG络合物的分子模拟:(a)孔雀石绿的结构, (b)CB[7]-MG 络合物的俯视图,(c)CB[7]-MG 络合物的侧面图 分子 100%进入主体分子时的荧光增强。 K是包结配 合物的平衡常数: H GHG (2) H G K H G (3) 实验通过加入不同浓度的 CB[7]与孔雀石绿溶液 中获得孔雀石绿的标准荧光。图6是根据公式(1)以 1/( 01FF )对1/[CB7]作图,得到一条线性关系良好 的直线(R = 0.9993),由此说明假设主客体形成 1:1 的 超分子配合物是正确的推测。由图 6我们可以计算出 20℃时的结合常数K = 1.8 × 104 L·mol–1。 同时,Job’s曲线常用来计算金属配合物的络合比, 同样也适用于超分子配合物体系。图7显示的是 CB[7] 与孔雀石绿络合物的 Job’s 曲线图,Job’s曲线是通过 MG 与CB[7]的不同摩尔比,同时,MG 和CB[7]的总 的浓度是一个固定的数值获得的,通过实验我们发现, 当[MG]/([MG]+[CB7]) = 0.5时其相对荧光强度最大, 由此更进一步证明孔雀石绿与 CB[7] 的包结比是 1:1。 0100000 200000 300000 400000 500000 0 2 4 6 8 10 12 R=0.9993 1/(F-F0) 1/CB7(M-1) Figure 6. The linear double recipr ocal plot of 1/(F/F0–1) vs 1/[H] (R = 0.99928), which shows the 1:1 stoichiometry of MG-CB7 complex 图6. MG-CB[7]络合物的双倒数曲线(R = 0.99928)的双倒数曲线 1/ (F/F0–1) vs. 1/[H] (R = 0.99928),这个证明了 MG-CB[7]是1:1 络合物 0.0 0.4 0.8 40 80 120 Relative fluorescence intensity [MG]/([MG]+[CB7]) Figure 7. Job’s plot for the CB7-Malachite Green complex, with the mole fraction of m ala chite green various from 0.1 - 0.9, 24℃ 图7. 24℃下 CB[7]-MG 络合物的 Job’s 曲线,孔雀石绿的摩尔分 数是 0.1~0.9 Copyright © 2012 Hanspub 10  葫芦[7]脲对孔雀石绿的包结作用及应用 3.4. 对CB[7]-MG 体系荧光强度的影响因素 3.4.1. 不同金属离子对 CB[7]-MG 体系的影响 图8(曲线a)示的是 CB[7]-MG 络合物在 466 nm (荧光发射峰)处的结合曲线图,将 Na+和Ca2+(CNa+ = 0.1 mol·L–1,CCa2+ = 0.1 mol·L–1)加入到CB[7]-MG 络 合物中,发现体系的荧光强度发生了剧烈的降低,这 是由于金属离子与葫芦脲的羰基氧离子具有更强的 结合能力,因此使得葫芦脲空腔中的孔雀石绿释放出 来从而使得络合物体系的荧光强度降低。当逐渐加入 Na+至1 mol·L–1 时,体系的荧光强度降低了61%,同 时当二价的Ca2+加入到络合物体系中时,体系的荧光 强度降低但是其降低的程度不会随着 Ca2+浓度的增 加而变化太大的(见图8)。 3.4.2. 不同表面活性剂对 CB[7]-MG 体系的影响 为了进一步研究MG-CB[7]的包结作用,我们探 讨了三种表面活性剂(阳离子表面活性剂(CTAB) 、阴 离子表面活性剂(SDS)和非离子表面活性剂 (Tween-80))对MG 与MG-CB[7]包结物的影响。所得 的结果如图 9所示,阳离子表面活性剂CTAB对MG 与MG-CB[7]络合物体系的影响不大;阴离子表面活 性剂 SDS 可以促进 MG 单体和 MG-CB[7]络合物的形 成,因此,将 SDS 加入到 MG和MG-C B[ 7] 络合物中 时体系的荧光强度都有明显的增加,但是这种增加趋 势不会随着 SDS 的浓度的增加而有了明显的变化; 0200 400 600 8001000 0 5 10 15 20 25 30 (c) (b) (a) F/F0 CB[7](10-6)M Figure 8. Fluorescence titration curves of MG (λem = 466 nm, 6.0 × 10–7 mol·L–1) with CB7: (a) In the absence of any metal ion, (b) In the presence of 0.1 mol·L–1 Na+, (c) In the presence of 0.1 mol·L–1 Ca2+. Triangle represent the fluorescence intensity changes of spec- trum with Na+/mol·L–1 (1) 0.001, (2) 0.004, (3) 0.02, (4) 0.1, (5) 1.0. Square represent the fluorescen ce intensity changes of spectrum with Ca2+/mol·L–1 (1) 0.001, (2) 0.004, (3) 0.02, (4) 0.1, (5) 0.4, 24˚C 图8. 24℃时 CB7存在下的 MG(λem = 466 nm, 6.0 × 10–7 mol·L–1) 的荧光滴定曲线:(a)不加入任何金属离子;(b)加入 0. 1 mol·L–1 的 Na+;(c)加入 0.1 m ol· L–1 的Ca2+。三角形代表的是不同浓度的 Na+/mol·L–1 存在下体系荧光强度的变化:(1) 0.001,(2) 0.004,(3) 0.02,(4) 0.1,(5) 1.0。正方形代表的是不同浓度 Ca2+/mol·L–1 存在 下体系荧光强度的变化:(1) 0.001,(2) 0.004,(3) 0.02 ,(4) 0.1,( 5) 0.4 04008001200 1600 0 1000 2000 3000 4000 5000 (4) (3) (2) (1) (6) (5) F V(surfactants)/ml Figure 9. Influence of surfactants concentration on the fluores- cence ntensity of CB7-MG system: (1) MG+ SDS; (2) CB7 + MG + SDS; (3) MG + CTAB; (4) CB7 + MG + CTAB; (5) MG + Tween-80; (6) CB7 + MG + Tw een-80; CMG = 6.0 × 10–7 mol L–1 CCB7 = 1.0 × 10–4 mol L–1; λ=466 nm, 24˚C 图9. 24℃时不同表面活性剂对 MG-CB[7]体系的影响:(1) MG+ SDS;(2) CB7 + MG + SDS;(3) MG + CTAB;(4) CB7 + MG + CTAB;(5) MG + Tween-80;(6) CB7 + MG + Tween-80;CMG = 6.0 × 10–7 mol L–1,CCB7 = 1.0 × 10–4 mol L–1;λ = 466 nm, 24˚C 此外,由实验我们可以看出,tween-80 对MG 和 MG-CB[7] 体系的荧光强度发生了明显的增加,同时 随着 tween-80的浓度的增加体系的荧光强度也会发 生相应的增加,这可能是非离子表面活性剂 tween-80 的加入使得体系的溶解度增加的缘故。 3.5. 热力学参数的计算 一般来说,有机分子与葫芦脲及其衍生物之间的 结合力包括范德华力、疏水作用、氢键和静电相互作 用[17,22,27,28]。为了计算 CB[7]-MG 体系的热力学参数 (热力学熵、热力学焓和吉布斯自由能),我们分别测 定了不同的温度下 MG-CB[7]体系的包结配位常数(图 10),我们进行了重复实验,包结配位常数 K的相对 误差一般是7%以内,由表 1我们可以知道包结配位 常数随着温度的升高而减小。 不同温度下的吉布斯自由能的变化值 G 可有公 式(4)计算出: GHTS (4) 假设 ΔH不会随着温度的变化发生明显的改变,我们 可以通过 Van’t Hoff公式(4)计算出热力学焓值和热力 学熵值, ln H S K RT R (5) 这里的 R是摩尔气体常数(R = 8.314 J·mol–1 K–1),K是 包结配位常数,以ln K 对1/T 作图得到一条线性关系 很好的直线(R = 0.9989),由斜率和截距可分别求得 H 和S ,各参数值见表 2 Copyright © 2012 Hanspub 11 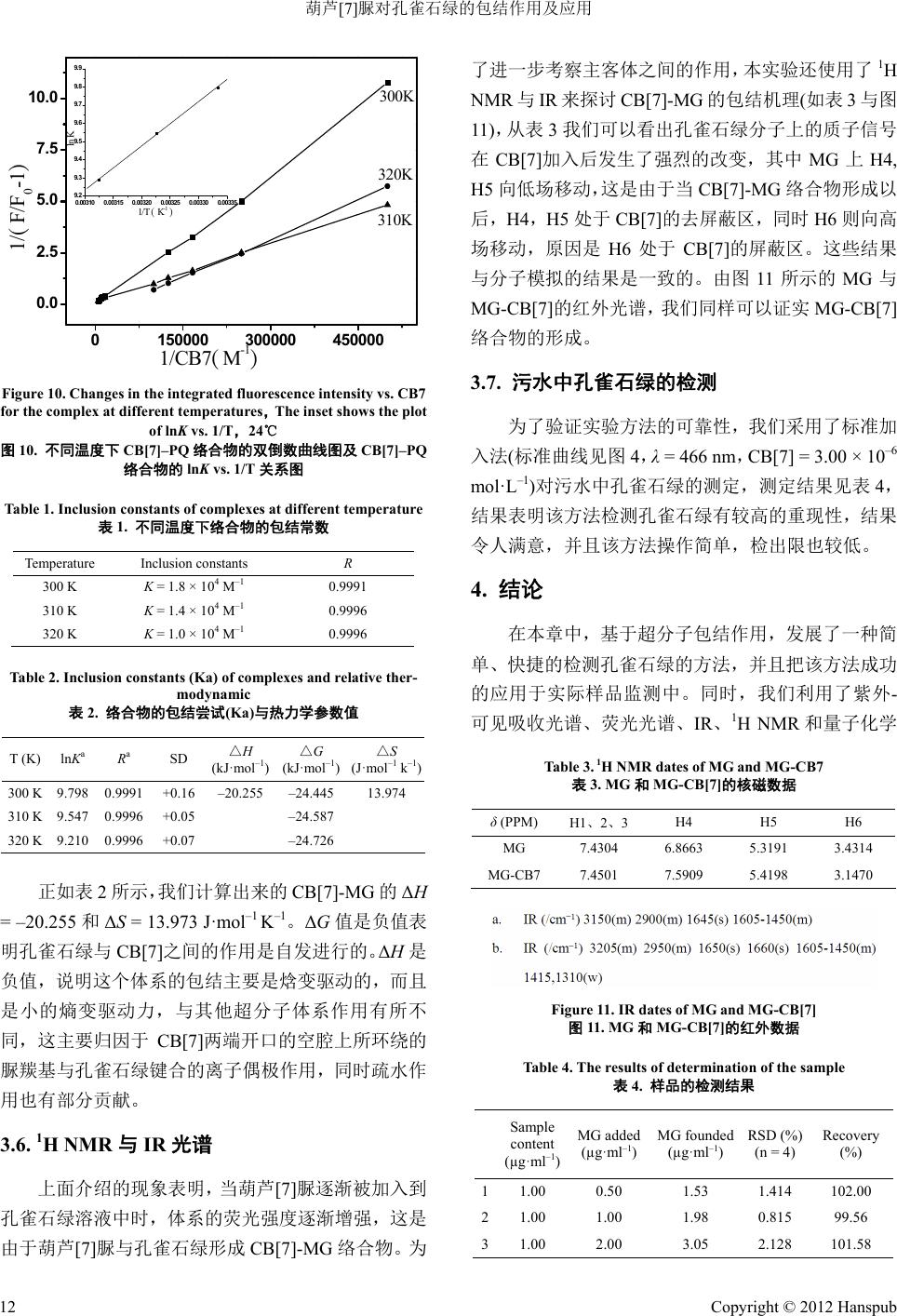 葫芦[7]脲对孔雀石绿的包结作用及应用 0150000 300000 450000 0.0 2.5 5.0 7.5 10.0 0.00310 0.00315 0.00320 0.00325 0.00330 0.00335 9. 2 9. 3 9. 4 9. 5 9. 6 9. 7 9. 8 9. 9 ln K 1/T ( K-1 )310K 320K 300K 1/(F/F0-1) 1/CB7(M-1) Figure 10. Chang es in the integrated fluorescence intensity vs. CB7 for the complex at different temperatures,The inset shows the plot of lnK vs. 1/T,24℃ 图10. 不同温度下 CB[7]–PQ 络合物的双倒数曲线图及CB[7]–PQ 络合物的 lnK vs. 1/T关系图 Table 1. Inclusion constants of complexes at different temperature 表1. 不同温度下络合物的包结常数 Temperature Inclusion constants R 300 K K = 1.8 × 104 M–1 0.9991 310 K K = 1.4 × 104 M–1 0.9996 320 K K = 1.0 × 104 M–1 0.9996 Table 2. I n c l us i o n constan t s (Ka) of complexes and relative ther- modynamic 表2. 络合物的包结尝试(Ka)与热力学参数值 T (K) lnKa Ra SD △H (kJ·mol–1) △G (kJ·mol–1) △S (J·mol–1 k–1) 300 K 9.798 0.9991 +0.16 –20.255 –24.445 13.974 310 K 9.547 0.9996 +0.05 –24.587 320 K 9.210 0.9996 +0.07 –24.726 正如表 2所示,我们计算出来的 CB[7]-MG 的ΔH = –20.255和ΔS = 13.973 J·mol–1 K–1。ΔG值是负值表 明孔雀石绿与CB[7]之间的作用是自发进行的。ΔH是 负值,说明这个体系的包结主要是焓变驱动的,而且 是小的熵变驱动力,与其他超分子体系作用有所不 同,这主要归因于 CB[7]两端开口的空腔上所环绕的 脲羰基与孔雀石绿键合的离子偶极作用,同时疏水作 用也有部分贡献。 3.6. 1H NMR与IR光谱 上面介绍的现象表明,当葫芦[7]脲逐渐被加入到 孔雀石绿溶液中时,体系的荧光强度逐渐增强,这是 由于葫芦[7]脲与孔雀石绿形成CB[7]-MG 络合物。为 了进一步考察主客体之间的作用,本实验还使用了1H NMR 与IR 来探讨 CB[7]-MG 的包结机理(如表 3与图 11),从表 3我们可以看出孔雀石绿分子上的质子信号 在CB[7]加入后发生了强烈的改变,其中 MG 上H4, H5 向低场移动,这是由于当 CB[7]-MG 络合物形成以 后,H4,H5处于CB[7]的去屏蔽区,同时 H6则向高 场移动,原因是H6处于 CB[7 ]的屏蔽区。这些结果 与分子模拟的结果是一致的。由图11 所示的 MG 与 MG-CB[7]的红外光谱,我们同样可以证实MG-CB[7] 络合物的形成。 3.7. 污水中孔雀石绿的检测 为了验证实验方法的可靠性,我们采用了标准加 入法(标准曲线见图 4, λ = 466 nm,CB[7] = 3.00 × 10–6 mol· L –1)对污水中孔雀石绿的测定,测定结果见表4, 结果表明该方法检测孔雀石绿有较高的重现性,结果 令人满意,并且该方法操作简单,检出限也较低。 4. 结论 在本章中,基于超分子包结作用,发展了一种简 单、快捷的检测孔雀石绿的方法,并且把该方法成功 的应用于实际样品监测中。同时,我们利用了紫外- 可见吸收光谱、荧光光谱、IR、1H NMR和量子化学 Table 3. 1 H NMR dates of MG and MG-CB7 表3. MG和MG-CB[7]的核磁数据 δ (PPM) H1、2、3H4 H5 H6 MG 7.4304 6.8663 5.3191 3.4314 MG-CB7 7.4501 7.5909 5.4198 3.1470 Figure 11. IR dates of MG and MG-CB[7] 图11. MG和MG-CB[7]的红外数据 Table 4. The results of determination of the sample 表4. 样品的检测结果 Sample content (µg·ml–1) MG added (µg·ml–1) MG founded (µg·ml–1) RSD (%) (n = 4) Recovery (%) 11.00 0.50 1.53 1.414 102.00 21.00 1.00 1.98 0.815 99.56 31.00 2.00 3.05 2.128 101.58 Copyright © 2012 Hanspub 12  葫芦[7]脲对孔雀石绿的包结作用及应用 Copyright © 2012 Hanspub 13 计算等方法研究了水溶液中孔雀石绿与葫芦[7]脲之 间的包结行为,探讨了MG-CB[7]的包结机理,提供 了一种新颖的检测环境污染物的方法,为葫芦脲在环 境污染物的分子识别作用中提供了一定的理论指导, 更进一步的扩展了葫芦脲的应用范围。 参考文献 (References) [1] G. Y. Chen, S. Miao. HPLC determination and MS confirmation of malachite green, gentian violet, and their leuco metabolite residues in channel catfish muscle. Journal of Agricultural and Food Chemistry, 2010, 58(12): 7109-7114. [2] D. J. Alderman. Malachite green: A review. Journal of Fish Disease, 1985, 8(3): 289-298. [3] S. L. Stead, H. Ashwin, B. H. Johnston, A. Dallas, S. A. Kazakov, J. A. Tarbin, M. Sharman, J. Kay and B. J. Keely. An RNA-ap- tamer based on assay for the detection and analysis of malachite green and leucomalachite green residues in fish tissue. Ana- lytical Chemistry, 2010, 82(7): 2652-2660. [4] F. Ding, W. Liu, F. Liu, Z. Y. Li and Y. Sun. A study of the interaction between malachite green and lysozyme by steady- state fluorescnece. Journal of Fluorescence, 2009, 19(5): 783- 791. [5] S. Srivastava, R. Sinha and D. Roy. Toxicological effect of malachite green. Aquatic Toxicology, 2004, 66(3): 319-329. [6] C. Berberidou, I. Poulios, N. P. Xekoukoulotaki and D. Mant- zavinos. Sonolytic, photocatalytic and sonophotocatalytic deg- radation of malachite green in aqueous solutions. Applied Ca- talysis B Environmental, 2007, 74(1-2): 63-72. [7] W. C. Andersen, S. B. Turnipseed, C. M. Karbiwnyk, R. H. Lee, S. B. Clark, W. D. Rowe, M. R. Madson and K. E. Miller. Mul- tiresidue method for the triphenylmethane dyes in fish, mala- chite green, crystal (gentian) violet and brilliant green. Analytica Chimica Acta, 2009, 637(1-2): 279-289. [8] J. L. Allen, J. R. Meinertz. Post-column reaction for simultane- ous analysis of chromatic and leuco forms of malachite green and crystal violet by high-performance liquid chromatography with photometric detection. Journal of Chromatography A, 1991, 536: 217-222. [9] S. M. Plakas, K. R. E. Said, G. R. Stehly and J. E. Roybal. Opti- mization of a liquid chromatographic method for determination of malachite green and its metabolites in fish tissues. Journal of AOAC International, 1995, 78(6): 1388-1394. [10] J. A. Tarbin, K. A. Barnes, J. Bygrave and W. H. H. Farrington. Screening and confirmation of triphenylmethane dyes and their leuco metabolites in trout muscle using HPLC-vis and LC-elec- trospray MS. Analyst, 1998, 123(12): 2567-2571. [11] C. Long, Z. Mai, B. Zhu, X. Zou, Y. Gao and X. Huang. New oxidant used for the post-column derivatization determination of malachite green and leucomalachite green residues in cultured aquatic products by high-performance liquid chromatography. Journal of Chromatography A, 2008, 1203(1): 21-26. [12] C. Marquez, W. M. Nau. Polarizabilities inside molecular containers. Angewandte Chemie International Edition, 2001, 40(23): 4387- 4390. [13] J. Lagona, P. Mukhopadhyay, S. Chakrabarti and L. Isaacs. The cucurbit[n]uril family. Angewandte Chemie International Edition, 2005, 44(31): 4844-4870. [14] K. Kim, N. Selvapalam, Y. H. Ko, K. M. Park, D. Kim and J. Kim. Functionalized cucurbiturils and their applications. Che- mical Society Reviews, 2007, 36(2): 267-279. [15] Y. Tan, S. W. Choi, J. W. Lee, Y. H. Ko and K. Kim. Synthesis and characterization of novel side-chain pseudopolyrotaxane containing cucurbituril. Macromolecules, 2002, 35(18): 7161- 7165. [16] J. W. Lee, Y. H. Ko, S.-H. Park, K. Yamaguchi and K. Kim. Novel pseudorotaxane-terminated dendrimers: Supramolecule modification of dendrimer periphery. Angewandte Chemie In- ternational Edition, 2001, 40(4): 746-749. [17] J. W. Lee, S. Samal, N. Selvapalam, H.-J. Kim and K. Kim. Cucurbituril homologues and derivatives: New opportunity in su- pramolecular chemistry. Accounts of Chemical Research, 2003, 36(8): 621-630. [18] J. Mohanty, W. M. Nau. Refractive index effects on the oscillator strength and radiative decay rate of 2,3-diazabicyclo[2,2,2] oct-2-ene. Photochemical and Photobiological Science, 2004, 3(11-12): 1026-1031. [19] C. Marquez, W. M. Nau. Polarizabilities inside molecular con- tainers. Angewandte Chemie International Edition, 2001, 40(23): 4387-4390. [20] S. D. Choudhury, J. Mohanty, H. Pal and A. C. Bhasikuttan. Cooperative metal ion binding to a cucurbit[7]uril-thioflavin T complex: Demonstration of a stimulus-responsive fluorescent supramolecular capsule. Journal of the American Chemical So- ciety, 2010, 132(4): 1395-1404. [21] F. Xing, D. Hao, C. Kai, X. Xin, X. L. Shi, F. X. Sai, Q. Z. Yun, J. Z. Qian, T. Zhu, Y. Z. Xiao and W. Gang. Design and synthesis of self-assembly supramolecular entities based on noncovalent interaction of cucurbit[5]uril, metal ions, and hydroxybenzene or its derivatives. Crystal Growth & Design, 2010, 10(7): 2901- 2907. [22] J. S. Liu, N. Jiang, J. Ma and X. Z. Du. Insight into unusual downfield NMR shifts in the inclusion complex of acridine or- ange with cucurbit[7]uril. European Journal of Organic Che- mistry, 2009, 2009(29): 4931-4938. [23] J. Kim, I. S. Jung, S. Y. Kim, E. Lee, J. K. Kang, S. Sakamoto, K. Yamaguchi and K. Kim. New cucurbituril homologues: Synthe- ses, isolation, characterization, and x-ray crystal structures of cucurbit[n]uril (n = 5, 7, and 8). Journal of the American Che- mical Society, 2000, 122(3): 540-541. [24] A. I. Day, A. P. Arnold, R. J. Blanch and B. Snushall. Control- ling factors in the synthesis of cucurbituril and its homologues. Journal of Organic Chemistry, 2001, 66(24): 8094-8100. [25] Y. M. Jeon, J. Kim, D. Whang and K. Kim. Molecular container assembly capable of controlling binding and release of its guest molecules: Re-versible encapsulation of organic molecules in sodium ion complexed cucurbituril. Journal of the American Chemical Society, 1996, 118(40): 9790-9791. [26] C. Marquez, R. R. Hudgins and W. M. Nau. The mechanism of host-guest complexation by cucurbituril. Journal of the Ame- rican Chemical Society, 2004, 126(18): 5806-5816. [27] C. Marquez, H. Fang and W. M. Nau. Cucurbiturils: Molecular nanocapsules for time-resolved fluorescence-based assays. IEEE Transactions on Nano-Bioscience, 2004, 3(1): 39-45. [28] A. C. Bhasikuttan, J. Mohanty, W. M. Nau and H. Pal. Efficient fluorescence enhancement and cooperative binding of an organic dye in a supra-bimolecular host-protein assembly. Angewandte Chemie International Edition, 2007, 46(22): 4120-4122. |