 Bioprocess 生物过程, 2012, 2, 65-69 http://dx.doi.org/10.12677/bp.2012.22011 Published Online June 2012 (http://www.hanspub.org/journal/bp) High Efficient Fermentation of Natamycin with Streptomyces gilvosporeus HBJ591* Huiting Song1, Rui Deng2, Zhengbing Jiang1,2# 1Hubei Key Laboratory of Industrial Biotechnology, Hubei University, Wuhan 2College of Life Science, Hubei University, Wuhan Email: #zhbjiang@hubu.edu.cn Received: May 13th, 2012; revised: May 23rd, 2012; accepted: May 27th, 2012 Abstract: Based on the study of sugar supplement process, high efficient fermentation with Streptomyces gilvosporeus HBJ591 was carried out via the optimization of the fermentation medium. When the reducing sugar concentration in the fermenter was 2.5%, the synthetic course of natamycin was extended effectively. Response surface method was used to optimize the fermention medium of HBJ591, then fed-batch fermentation was carried out in 16 L fermenter, the nata- mycin fermentation level reached 15.7 g/L, and the highest yield was 4.8 times higher than the original process. Keywords: Natamycin; Response Surface Method; Fed-Batch Fermentation 褐黄孢链霉菌 HBJ591 纳他霉素高效发酵工艺研究* 宋慧婷 1,邓 锐2,江正兵 1,2# 1湖北大学工业生物技术湖北省重点实验室,武汉 2湖北大学生命科学学院,武汉 Email: #zhbjiang@hubu.edu.cn 收稿日期:2012 年5月13 日;修回日期:2012 年5月23 日;录用日期:2012 年5月27 日 摘 要:本文以褐黄孢链霉菌 HBJ591为基础,研究了补糖工艺对纳他霉素发酵的影响,结合发酵培养基的优 化,实现了纳他霉素的高产发酵。结果表明,维持发酵罐中还原糖浓度为 2.5%,能有效延长纳他霉素的合成时 间。通过响应曲面法对褐黄孢链霉菌 HBJ591 菌株的发酵培养基进行优化后,结合补糖工艺,在 16 L发酵罐中 进行补料分批发酵,纳他霉素的发酵水平达到 15.7 g/L,比原始发酵工艺的效价提高 4.8 倍。 关键词:纳他霉素;响应曲面法;补料发酵 1. 引言 纳他霉素(Natamycin)是一种高效、广谱的抗真菌 剂,能有效抑制或杀死霉菌、酵母菌、丝状真菌,降 低致病性真菌毒素产生,自 1955 年由 Struyk 等人发 现以来,因其无毒,且不致突变、不致癌、不致敏、 不致畸,难溶于水和油脂,口服毒性小,并且对产品 口感特性无任何影响等优点,已在乳制品、肉类、水 果、饮料等食品工业中得到广泛的应用[1]。由于纳他 霉素优良的抗菌性及安全性,已经被欧美许多国家广 泛应用于食品工业和医药上,我国卫生部早在 1997 年正式批准其为食品添加剂,应用于乳制品、肉类、 水果、饮料等食品中。 纳他霉素(Natamycin)主要由褐黄孢链霉菌(Strep- tomyces gilvosporeus)[2] 、纳塔尔链霉菌(S t rept omyces natalensis)[3] 和恰塔努加链霉菌(Streptomyces chata- noogensis)[4]发酵生产。目前我国主要利用褐黄孢链霉菌 *基金项目:教育部新世纪人才计划(NCET-10-0153);国家高技术 研究发展计划(863 计划)(2012AA020403);湖北省自然科学基金杰 出青年基金(2011CDA080)。 #通讯作者。 Copyright © 2012 Hanspub 65  褐黄孢链霉菌 HBJ591 纳他霉素高效发酵工艺研究 生产纳他霉素,发酵周期 5~7 天,发酵产量一般为 7~8 g/L[5],发酵水平低,生产成本高,是目前限制我国纳他 霉素产业大规模发展的主要因素。 本文在前期研究得到高产专利菌株(褐黄孢链霉 菌HBJ591)的基础上,采用补糖工艺和响应曲面法培 养基优化对纳他霉素发酵工艺进行研究,较系统的研 究了影响 HBJ591发酵纳他霉素的因素,有效提高纳 他霉素发酵的效价。 2. 实验材料和方法 2.1. 菌种 褐黄孢链霉菌(Streptomyces gilvosporeus) HBJ591, 本实验室专利菌株。 2.2. 培养基 斜面种子培养基:葡萄糖10 g/L、大豆蛋白胨 5 g/L、酵母粉 3 g/L、麦芽浸出粉 3 g/L、脱脂粉 15 g/L pH 7.0。 种子培养基:豆饼粉 1%、酵母粉 0.3%、葡萄糖 1.8% pH 7.2。 发酵基础培养基:豆饼粉 2.8%、酵母粉 0.85%、 葡萄糖 4.0% pH 7.2。 2.3. 分析方法 纳他霉素含量的测定:HPLC 高效液相色谱法[6]。 取发酵样品 1 ml加9 ml甲醇浸泡,常温浸提 12 小时 以上,普通滤纸过滤取滤液再经0.2 um微孔滤膜过滤 后进样。分析条件为色谱柱 Sepax HP-C18,流动相甲 醇:水 = 70:30,检测波长 303 nm。 还原糖的测定:DNS 法[7]。 氨基氮的测定:甲醛法[8]。 可溶性磷的测定:磷钼蓝–氯化亚锡比色法[9]。 生物量的测定:定量称取 5克发酵液,离心洗涤 2次,将菌丝体于 105℃烘干致恒重,生物量 = 干菌 丝体量/发酵液量 × 100%[10]。 2.4. 仪器设备 HQL150B 恒温冷冻摇床(中国科学院武汉科学仪 器厂),Agilent 1100高效液相色谱仪,SP-752 型紫外 可见分光光度计(上海光谱仪器有限公司),16 L全自 动发酵罐(美国 NBS 公司)。 2.5. 基础发酵培养条件 种子用二级培养,一级种为 250 ml三角瓶摇瓶种 子,每个三角瓶装培养基 30 ml;二级种为 500 ml三 角瓶摇瓶种子,每个三角瓶装种子培养基 50 ml,接 种量 10%。发酵温度:28℃~29℃;摇瓶装量:500 ml 三角瓶装 50 ml;摇床转速:220 r/min;摇瓶发酵周 期:7天。 16 L发酵罐:发酵温度 28℃~29℃,转速 500 r/min,通风量 1:1.6。 2.6. 补糖方法 摇瓶补糖方法:从 48 小时开始每 12 小时向每个 摇瓶补加 1.5 ml 50%浓度的无菌葡萄糖。 16 L发酵罐的补糖方法:用 50%浓度的无菌葡萄 糖,通过蠕动泵用电子天平计量补入,维持还原糖浓 度在 2.5%左右。 3. 实验结果与讨论 3.1. 补糖对褐黄孢链霉菌发酵合成纳他霉素 的影响 3.1.1. 不补糖条件下褐黄孢链霉菌发酵生长特性 通过检测不补糖条件下褐黄孢链霉菌 HBJ591发 酵过程中不同时间发酵液菌体生物量、纳他霉素效 价、pH、还原糖、可溶磷及氨态氮等代谢参数,绘制 代谢变化曲线如图 1。 从图中可以看出,发酵 24 h时褐黄孢链霉菌生物 量达最大值,此时 pH下降到 5.0 左右,氨基氮和可 溶性磷下降;在发酵 8小时开始检测到纳他霉素产生, 还原糖约为 2.0%~3.5%,期间纳他霉素大量合成,在 还原糖低于 2.0%后,纳他霉素合成减缓,64 h达高峰, 纳他霉素产量为 2. 7 g/L发酵液,说明葡萄糖浓度 2.0% 可能是发酵关键点。 3.1.2. 初步的补糖试验效果分析 根据上述试验结果,设计在还原糖降到 2.0%时开 始补加葡萄糖,长时间维持发酵液中还原糖的浓度在 2.0%~3.0%,监测纳他霉素的产量,见图 2。从图 2 中可以看出,纳他霉素的合成时间可延长至 120 小时, Copyright © 2012 Hanspub 66 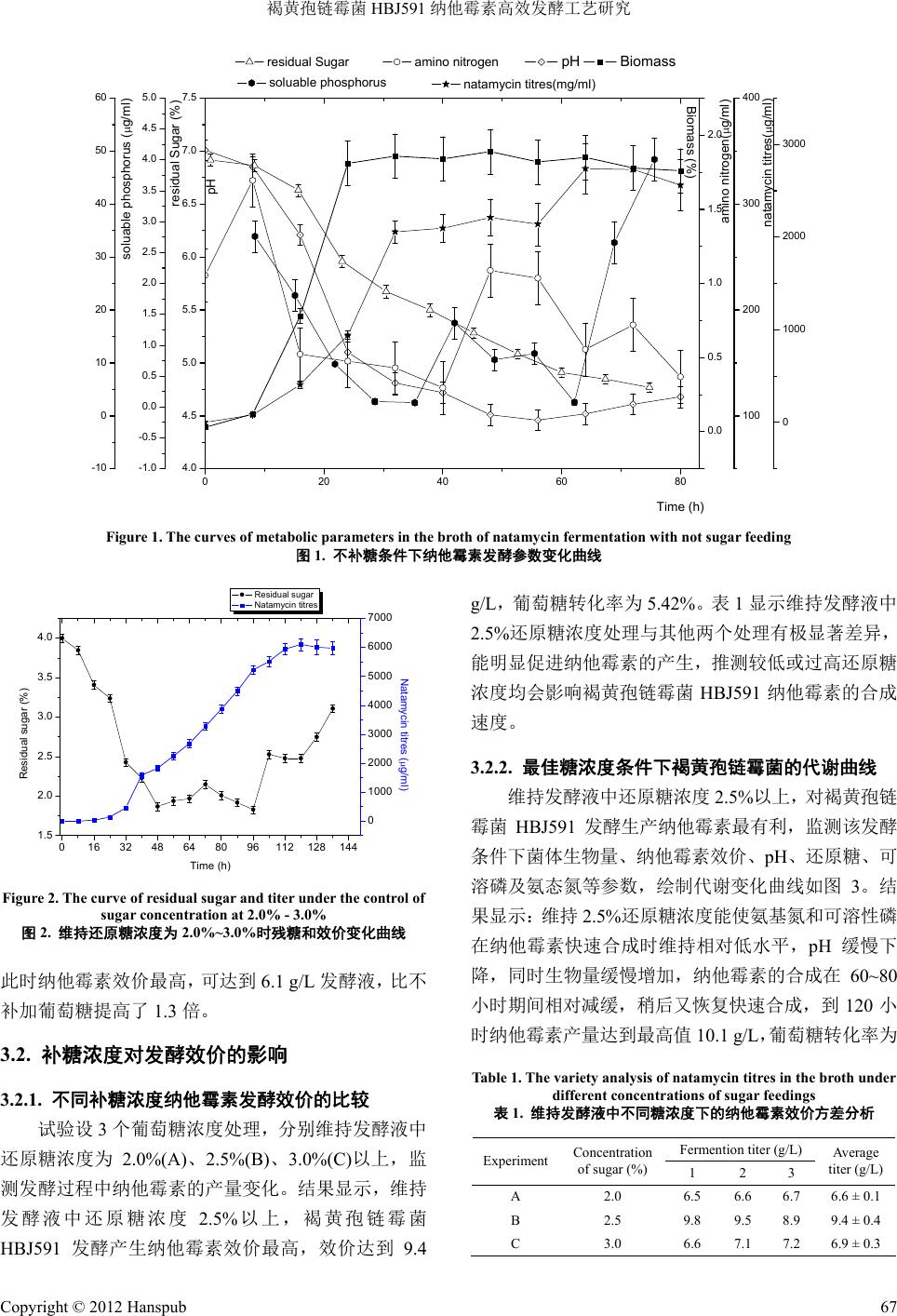 褐黄孢链霉菌 HBJ591 纳他霉素高效发酵工艺研究 Copyright © 2012 Hanspub 67 0 20406080 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5 pH Biomass Time ( h ) pH 0.0 0.5 1.0 1.5 2.0 Biomass (%) -1.0 -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 residual Sugar (%) residual Sugar 100 200 300 400 amino nitrogen(g/ml) amino nitrogen -10 0 10 20 30 40 50 60 soluable phosphorus (g/ml) soluable phosphorus 0 1000 2000 3000 natamycin titres(g/ml) natamycin titres(mg/ml) Figure 1. The curves of metabolic parameters in the broth of natamycin fermentation with not sugar feeding 图1. 不补糖条件下纳他霉素发酵参数变化曲线 016 32 48 6480 96112128144 1.5 2.0 2.5 3.0 3.5 4.0 Residual sugar Natamycin titres Time (h) Residual sugar (%) 0 1000 2000 3000 4000 5000 6000 7000 Natamycin titres (g/ml) Figure 2. The curve of residual sug a r and titer under the contr ol of sugar concentration at 2.0% - 3.0% 图2. 维持还原糖浓度为 2.0%~3.0%时残糖和效价变化曲线 此时纳他霉素效价最高,可达到 6.1 g/L发酵液,比不 补加葡萄糖提高了 1.3倍。 3.2. 补糖浓度对发酵效价的影响 3.2.1. 不同补糖浓度纳他霉素发酵效价的比较 试验设 3个葡萄糖浓度处理,分别维持发酵液中 还原糖浓度为 2.0%(A)、2.5%(B)、3.0%(C)以上,监 测发酵过程中纳他霉素的产量变化。结果显示,维持 发酵液中还原糖浓度 2.5%以上,褐黄孢链霉菌 HBJ591 发酵产生纳他霉素效价最高,效价达到 9.4 g/L,葡萄糖转化率为 5.42%。表 1显示维持发酵液中 2.5%还原糖浓度处理与其他两个处理有极显著差异, 能明显促进纳他霉素的产生,推测较低或过高还原糖 浓度均会影响褐黄孢链霉菌 HBJ591 纳他霉素的合成 速度。 3.2.2. 最佳糖浓度条件下褐黄孢链霉菌的代谢曲线 维持发酵液中还原糖浓度 2.5%以上,对褐黄孢链 霉菌 HBJ591发酵生产纳他霉素最有利,监测该发酵 条件下菌体生物量、纳他霉素效价、pH、还原糖、可 溶磷及氨态氮等参数,绘制代谢变化曲线如图 3。结 果显示:维持 2.5%还原糖浓度能使氨基氮和可溶性磷 在纳他霉素快速合成时维持相对低水平,pH 缓慢下 降,同时生物量缓慢增加,纳他霉素的合成在 60~80 小时期间相对减缓,稍后又恢复快速合成,到 120 小 时纳他霉素产量达到最高值 10.1 g/ L,葡萄糖转化率为 Table 1. The variety analysis of natamycin titres in the broth under different concentrations of sugar feedings 表1. 维持发酵液中不同糖浓度下的纳他霉素效价方差分析 Fermention titer (g/L) Experiment Concentration of sugar (%) 1 2 3 Average titer (g/L) A 2.0 6.5 6.6 6.7 6.6 ± 0.1 B 2.5 9.8 9.5 8.9 9.4 ± 0.4 C 3.0 6.6 7.1 7.2 6.9 ± 0.3 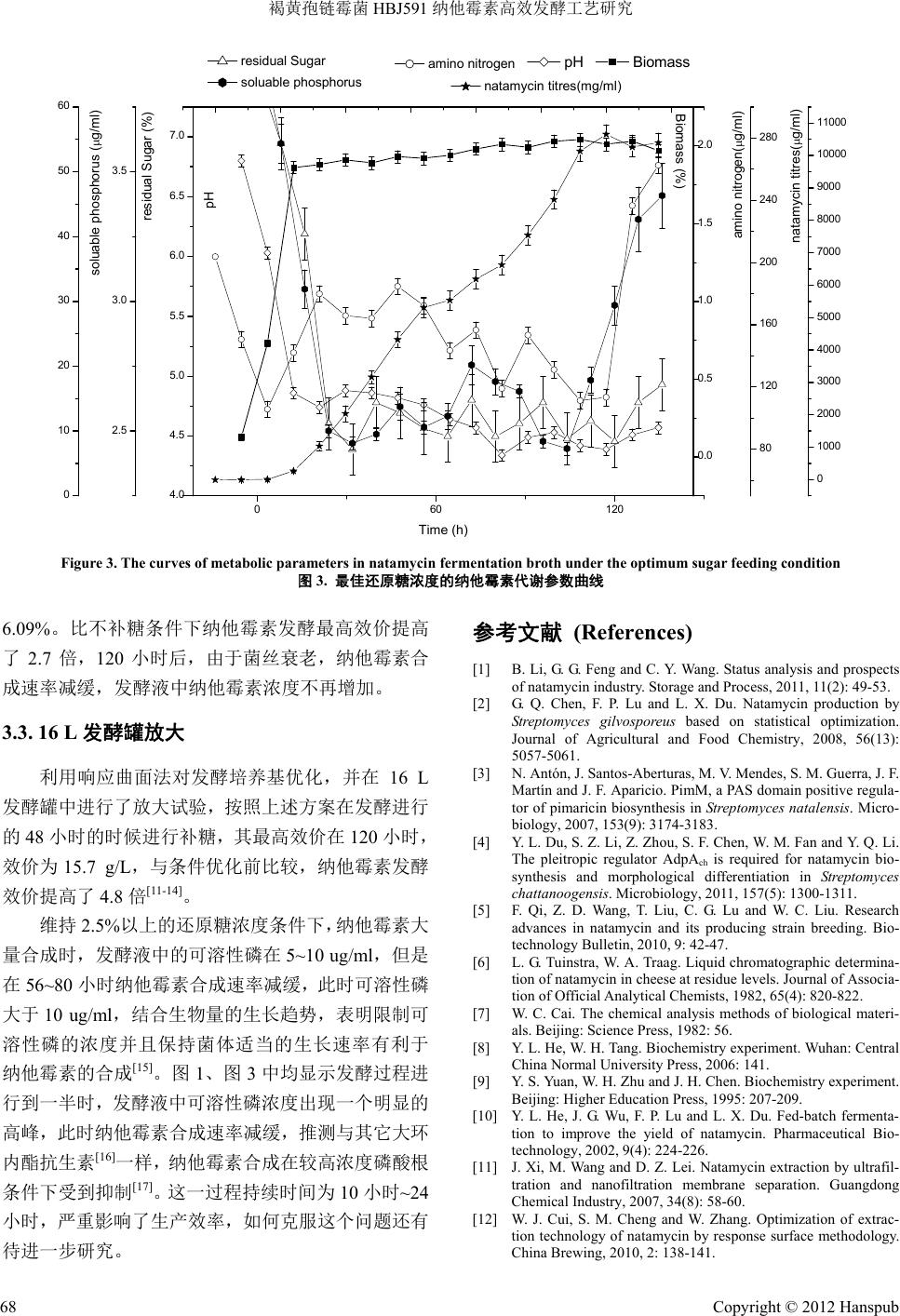 褐黄孢链霉菌 HBJ591 纳他霉素高效发酵工艺研究 4.0 4.5 5.0 5.5 6.0 6.5 7.0 pH Biomass pH 0.0 0.5 1.0 1.5 2.0 Biomass (%) 060120 2.5 3.0 3.5 residual Sugar (%) Time (h) residual Sugar 0 10 20 30 40 50 60 soluable phosphorus (g/ml) soluable phosphorus 80 120 160 200 240 280 amino nitrogen(g/ml) amino nitrogen 0 1000 2000 3000 4000 5000 6000 7000 8000 9000 10000 11000 natamycin titres(g/ml ) natamycin titres(mg/ml) Figure 3. The curves of metabolic parameters in natamycin fermentation broth under the optimum sugar feeding condition 图3. 最佳还原糖浓度的纳他霉素代谢参数曲线 6.09%。比不补糖条件下纳他霉素发酵最高效价提高 了2.7 倍,120 小时后,由于菌丝衰老,纳他霉素合 成速率减缓,发酵液中纳他霉素浓度不再增加。 3.3. 16 L发酵罐放大 利用响应曲面法对发酵培养基优化,并在16 L 发酵罐中进行了放大试验,按照上述方案在发酵进行 的48 小时的时候进行补糖,其最高效价在 120 小时, 效价为 15.7 g/L,与条件优化前比较,纳他霉素发酵 效价提高了 4.8倍[11-14]。 维持 2.5%以上的还原糖浓度条件下,纳他霉素大 量合成时,发酵液中的可溶性磷在 5~10 ug/ml,但是 在56~80 小时纳他霉素合成速率减缓,此时可溶性磷 大于 10 ug/ml,结合生物量的生长趋势,表明限制可 溶性磷的浓度并且保持菌体适当的生长速率有利于 纳他霉素的合成[15]。图1、图 3中均显示发酵过程进 行到一半时,发酵液中可溶性磷浓度出现一个明显的 高峰,此时纳他霉素合成速率减缓,推测与其它大环 内酯抗生素[16]一样,纳他霉素合成在较高浓度磷酸根 条件下受到抑制[17]。这一过程持续时间为 10 小时~24 小时,严重影响了生产效率,如何克服这个问题还有 参考文献 (Ref 待进一步研究。 erences) g. Status analysis and prospects of natamycin industry. Storage and Process, 2011, 11(2): 49-53. levels. Journal of Associa- 141. se surface methodology. [1] B. Li, G. G. Feng and C. Y. Wan [2] G. Q. Chen, F. P. Lu and L. X. Du. Natamycin production by Streptomyces gilvosporeus based on statistical optimization. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5057-5061. [3] N. Antón, J. Santos-Aberturas, M. V. Mendes, S. M. Guerra, J. F. Martín and J. F. Ap aricio. PimM, a PAS domain positive regula- tor of pimaricin biosynthesis in Streptomyces natalensis. Micro- biology, 2007, 153(9): 3174-3183. [4] Y. L. Du, S. Z. Li, Z. Zhou, S. F. Chen, W. M. Fan and Y. Q. Li. The pleitropic regulator AdpA is ch required for natamycin bio- synthesis and morphological differentiation in Streptomyces chattanoogensis. Microbiology, 2011, 157(5): 1300-1311. [5] F. Qi, Z. D. Wang, T. Liu, C. G. Lu and W. C. Liu. Research advances in natamycin and its producing strain breeding. Bio- technology Bulletin, 2010, 9: 42-47. [6] L. G. Tuinstra, W. A. Traag. Liquid chromatographic determina- tion of natamycin in cheese at residue tion of Official Analytical Chemists, 1982, 65(4): 820-822. [7] W. C. Cai. The chemical analysis methods of biological materi- als. Beijing: Science Press, 1982: 56. [8] Y. L. He, W. H. Tang. Biochemistry experiment. Wuhan: Central China Normal University Press, 2006: [9] Y. S. Yuan, W. H. Zhu and J. H. Chen. Biochemistry experiment. Beijing: Higher Education Press, 1995: 207-209. [10] Y. L. He, J. G. Wu, F. P. Lu and L. X. Du. Fed-batch fermenta- tion to improve the yield of natamycin. Pharmaceutical Bio- technology, 2002, 9(4): 224-226. [11] J. Xi, M. Wang and D. Z. Lei. Natamycin extraction by ultrafil- tration and nanofiltration membrane separation. Guangdong Chemical Industry, 2007, 34(8): 58-60. [12] W. J. Cui, S. M. Cheng and W. Zhang. Optimization of extrac- tion technology of natamycin by respon China Brewing, 2010, 2: 138-141. Copyright © 2012 Hanspub 68  褐黄孢链霉菌 HBJ591 纳他霉素高效发酵工艺研究 [13] G. Y. Xu, J. M. Luo, D. S. Yang and M. Wang. Optimization of natamycin fermentation culture medium and condtions. Journal reus. Wuhan: Huazhong . Advances in the research . Study on extrction condition and assay method of of Microbiology, 2007, 127(4): 73-78. [14] W. W. Hou. Optimization of fermentation process of natamycin producing strain Streptomyces gilvospo Agricultural University, 2010. [15] J. L. Liang. Strain mutation via satellite, process optimization and scale-up for industrial natamycin production. Hangzhou: Zhenjiang University Library, 2007. [16] L. G. Yu, X. H. Zhang and W. J. Gong of a new food Additive natamycin. China Food Additives, 2005, 4: 68-80. [17] W. J. Cui natamycin. Hebei: Hebei Agricultural University, 2010. Copyright © 2012 Hanspub 69 |