Hans Journal of Food and Nutrition Science
Vol.
09
No.
04
(
2020
), Article ID:
38791
,
9
pages
10.12677/HJFNS.2020.94041
探讨补充Lactobacillus plantarum GKM3在肌力退化及肌肉流失之功效
李宗儒1,吕庭宇1,蔡侑珊1,陈炎链1,陈劲初1,2,3,4*
1葡萄王生技股份有限公司,台湾 桃园
2国立台湾大学食品科技研究所,台湾 台北
3实践大学食品营养与保健生技学系,台湾 台北
4中原大学生物科技学系,台湾 桃园
收稿日期:2020年11月4日;录用日期:2020年11月18日;发布日期:2020年11月25日

摘要
因应高龄社会的趋势,肌少症(Sarcopenia)是长者应注意的潜在健康危机。肌肉的减少除了在运动表现及行动能力下降外,骨骼肌持续随着时间的流失造就了基础代谢全面性的降低,许多文献证实肌少症影响着个体在临床上愈后的表现,因此提早进行肌少症的预防与诊断,是可以降低残疾,住院以及死亡的发生率。由于至今没有一种万灵丹能有效的治疗老化,因此要如何减少肌力退化及肌肉量流失为目前治疗肌少症的核心策略。近期研究指出益生菌可以调节肠道菌群,也有部分的研究证实益生菌所改善的肠道菌丛能有效的增加蛋白质的吸收,但尚未有研究提出哪些益生菌能具有增加肌肉量与质之功效。故本研究先利用小鼠纤维母细胞(C2C12)建立地塞米松(dexamethasone)诱导肌肉萎缩之细胞平台,发现益生菌Lactobacillus plantarum GKM3具有预防肌肉萎缩之潜力,接着,我们在动物模式上,藉由禁锢(Cast immobilization)七日方式来诱导小鼠肌肉萎缩,在禁锢的第一天就将GKM3冻干粉(500 mg/kg)喂食小鼠并连续喂食两周,结果也发现在两周后量测小鼠肌耐力以及握力与对照组相比都有着显著的差异(p < 0.05),此篇研究结果可以推测GKM3有助于肌肉萎缩情况下帮助小鼠回复肌耐力与肌肉量。
关键词
肌少症,肌肉萎缩,益生菌,Lactobacillus plantarum GKM3
The Ameliorative Effect of Lactobacillus plantarum GKM3 on Muscle Atrophy
Tsung-Ju Li1, Ting-Yu Lu1, You-Shan Tsai1, Yen-Lien Chen1, Chin-Chu Chen1,2,3,4*
1Grape King Bio Ltd., Taoyuan Taiwan
2Institute of Food Science and Technology, National Taiwan University, Taipei Taiwan
3Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shih Chien University, Taipei Taiwan
4Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan

Received: Nov. 4th, 2020; accepted: Nov. 18th, 2020; published: Nov. 25th, 2020

ABSTRACT
Sarcopenia is a potential healthcare crisis in elderly population. It is a skeletal muscle disorder that involved in age-progressive muscle reduction which causes an accelerated decline in strength, mobility, athletic performance, and basal metabolism. Study has found that sarcopenia also has adverse effects in clinical outcome because they are more likely to fall and become hospitalized. Therefore, early prevention and diagnosis of sarcopenia can reduce the incidence of disability, hospitalization and death. Sarcopenia has become an intense topic to focus on because decreasing muscle degeneration is the most effective strategy to improve the lifestyle at old age. Recent studies have shown that probiotics can help to regulate the intestinal microbiome by effectively increase the absorption of ingested protein. However, few researches have proposed which probiotics can help reduce muscle atrophy while sustaining its quality. In this study, we first established cellular platform mouse fibroblasts (C2C12) with dexamethasone treatment to induce myotube atrophy. We found that the probiotic Lactobacillus plantarum GKM3 has the potential to prevent myotube atrophy from dexamethasone damage. Next, we performed seven days cast immobilization (IM) on C57BL/6J mice as our in vivo muscle atrophy animal model. The IM mice were fed at beginning of the trial with GKM3 lyophilized powder (500 mg/kg) for two consecutive weeks. Muscle endurance and grip strength showed significantly improvement when compared with the control after two weeks (p < 0.05). The result showed that supplementation of GKM3 has ameliorative effect on IM induced muscle atrophy.
Keywords:Sarcopenia, Muscle Atrophy, Probiotic, Lactobacillus plantarum GKM3

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
因应高龄社会的趋势,肌少症(Sarcopenia)是一种常见的衰老相关的疾病之一,这名称来自于希腊文字肉“sarx”与缺乏“penia”所组成。肌肉减少症通常伴随骨骼肌质量和力量的逐渐流失,导致慢性病的可能 [1]。根据统计,肌少症盛行率发生在60岁以上族群约~13%,80岁以上盛行率可能增加到30~50% [2],在医院病房的患病率高达35% [3]。许多文献证实肌少症影响着个体在临床上愈后的表现,并会在以后的生活中对健康产生许多负面影响 [4],因此提早进行肌少症的预防与诊断,是可以降低残疾,住院以及死亡的发生率。
目前肌少症的机转包含年龄、運動量下降、营养失衡、内分泌与神经退化交互影响下累积而成的多种复杂原因。由于身体的退化所导致的走路变慢,活动力下降,进而体重流失而降低了整体热量消耗,这些主要来源都与骨骼肌肉脱离不了关系 [5]。研究普遍指出成年人每天需摄取约1.0~1.2 g/kg总蛋白质和必须氨基酸的补充才能维持肌肉的修复和生长 [6]。然而,随着年纪的变化,个体贺尔蒙如生长激素、睪固酮素都会下降导致食欲不振,相对年轻时可吸收的营养在年老时吸收率都会降低 [7]。随着老龄化社会的来临逼近,因此要如何减少肌力退化及肌肉量流失为目前治疗肌少症的核心课题。
近期研究指出益生菌可以调节肠道菌群,并且能促进肠壁细胞分泌抗菌物质减少病原菌的贴附,也有文献证实益生菌能有效的增加蛋白质的吸收 [8],故补充益生菌对于肌少症相关治疗提出一种新的可能。不仅如此,益生菌也已知可降低肠道发炎,提升免疫系统能力,这对肌少症常被诊断出低程度发炎因子如介白素-6(IL-6)也有所帮助 [9]。先前研究指出植物乳杆菌GKM3 (Lactobacillus plantarum GKM3)在动物实验中可经由调整Wistar大鼠的肠道菌群 [10],能有效降低在高脂肪饮食所造成的发炎反应。由于尚未有研究探讨GKM3是否能具有减少肌少症之功效。故本案利用小鼠纤维母细胞(C2C12)建立地塞米松(dexamethasone)诱导肌肉萎缩之细胞平台,并研究GKM3益生菌是否具有预防肌肉萎缩之潜力,接着,我们在动物模式上,借由禁锢Cast immobilization (IM)七日方式来诱导小鼠肌肉萎缩,在固定的第一天就将GKM3其冻干粉喂食小鼠并连续喂食两周,评估GKM3在缓解肌少症所造成的肌肉萎缩之功效。
2. 材料与方法
2.1. 实验菌株
来自葡萄王公司传统发酵酸菜分离筛得並经16SrRNA鉴定为植物乳杆菌,代号为植物乳杆菌GKM3。
2.2. 植物乳杆菌GKM3益生菌冻干粉末制备
植物乳杆菌GKM3培养于1 L MRS培养基中,温度控制在37℃维持16小时,接著以5000 RPM离心10分钟、室溫25℃、取得菌泥,冷冻干燥后精秤,调整菌数为5 × 109 cfu/g保存于−20℃备用並进行动物实验。
2.3. 试验动物与饲养
本次试验遵守动物伦理委员会3R规范,以C57BL/6J小鼠(公)12只进行试验,体重介于 24~26 g之間。动物房温度控制在22℃ ± 2℃,湿度控制在55%~65%,光照与黑暗各十二小时(07:00~19:00为光照期;19:00~07:00为黑暗期)。
2.4. 细胞培养與分化
小鼠纤维母细胞(C2C12;购自ATCC)、培养于DMEM -HG(Sigma)培养液含10% fetal bovine serum (GIBCO); 100 U/ml Penicillin; 100 μg/ml Streptomycin; 0.25 μg/ml Amphotericin B (Biological Industries),培养于37℃,5% CO2的细胞培养箱。当细胞生长至8分满时便可加以继代。继代时先吸掉原有的细胞培养液,再使用以37℃预温过的1X PBS缓冲液洗涤2次后,加入适量Trypsin-EDTA solution,放入37℃培养箱3分钟,取出细胞轻拍打培养皿至细胞完全脱落,再以3:1适量DMEM-HG培养液中和trypsin并将细胞冲下,以1200 rpm离心五分钟后去除上清液,并添加新鲜培养液后依适当浓度稀释转移至新的培养皿中;分化时则换成DMEM-HG(2% horse serum)並每两天换一次培养基,持续一周,分化第四天后开始進行GKM3处理(~5 × 106 cfu) 24小时后再給予藥物處理(Dexamethasone 10 µM),最後同樣使用以37℃预温过的1X PBS缓冲液洗涤2次,並進行苏木紫-伊红(H&E)染色並观察分化后的状况。
2.5. 动物肌少症模式
控制动物房之温度(22℃± 2℃)及湿度(55%~65%),並饲养於动物房内之独立饲养笼架上。C57BL/6四周龄小鼠适应期为一周后开始后续实验,本试验共设置3组试验组,分别为Sham组、对照组(Vehicle) 组、GKM3(植物乳杆菌):3组,每组动物各4只。对照组动物喂食等体积之二次纯水(ddH2O),试验物质剂量配置浓度为500 mg/kg,试验物质采用胃管经口喂食,其使用体积10 mL/kg bw/次,试验物质于投药前现配,每日喂食后持续观察,记录体重、摄食与饮水重量。参考文献 [11],肌少症将以cast immobilization (IM)方式进行诱导达7天,此种方法是使用物理方式限制小鼠的行动,并在小鼠上面放置水及饲料可以直接进食,以模擬在长久不动所造成肌肉萎缩之环境。接着,卸除IM后再让小鼠可行动达7天来观察恢复期。试验前先将动物进行小鼠活动力暨肌力测量仪器适应2天。待IM诱导达7天並卸除IM后,先测定肌握力测试,再测定肌耐力测试以定速18 m/min直至30 min。试验结束再测定14天並进行牺牲,取其后肢骨骼肌肉并称重记录。肌耐力试验则是参考文献,将小鼠放置Rodent Treadmill, with Mouse Lane Assembly (#47300, UgoBasile),底端安装电击感应装置,小鼠肌耐力不足则会碰触底部及电击乙次,这样可量化小鼠肌耐力。
2.6. 统计分析
试验结果均以Mean ± SD表示,并使用GraphPad Prism (version 8.0)进行实验数据统计分析。统计方法以司徒顿t检定(student’s t-test)判定组间差异。若统计结果p值小于0.05 (p < 0.05)时,则判定两组间具有显著差异。
3. 结果
3.1. 植物乳杆菌GKM3与C2C12小鼠纤维母细胞分化之影响
图1为本次植物乳杆菌 GKM3于C2C12小鼠纤维母细胞分化之结果。经由苏木紫–伊红(H&E)染色后并观察分化的状况可发现小鼠纤维母细胞在分化三天形成许多肌管(myotube)。从结果可发现经由地塞米松药物处理后的肌管会显着萎缩(图右上)。相对,若有GKM3的处理,地塞米松药物的伤害将会减少(图右下)。表示分化后的肌管(n = 60)上相较于单纯给予药物组别,可显着減緩其肌管萎缩含量(p < 0.05)。
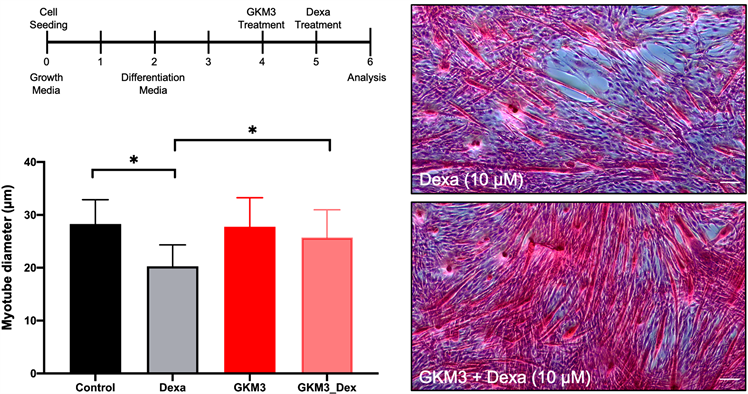
Figure 1. GKM3 has protective effect for C2C12 myotube against dexamethasone damage. Values with * symbol mean there is significantly difference (p < 0.05)
图1. GKM3对C2C12肌管对于地塞米松药物处理具有保护作用。*代表有显著差异(p < 0.05)
3.2. 植物乳杆菌GKM3粉末对固定诱导肌少症小鼠摄食与体重变化之影响
表1为小鼠之体重两周纪录。由结果得知,全程实验小鼠无任何死亡、临床与生理状况异常,各组之间在起始体重与14天后结果并无显着差异(p > 0.05)。在食物摄取量如图2,有固定诱导肌少症小鼠组别GKM3组与无固定组别相比,虽有增加趋势,但统计结果老鼠固定與餵食GKM3并不会影响食物量摄取(p > 0.05)。
Table 1. Effect of Lactobacillus plantarum GKM3 powder on body weights and weight change in IM mouse
表1. 植物乳杆菌GKM3粉对IM诱导肌少症小鼠体重和体重变化之影响
All values presented here are the mean ± SD (n = 4). No significant difference was found between each group.
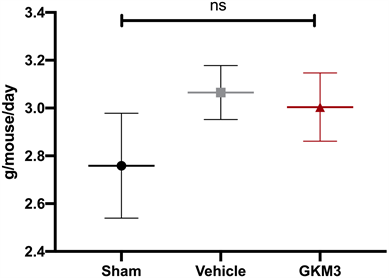
Figure 2. The effect of Lactobacillus plantarum GKM3 powder on IM mouse food uptake. No significant difference was found between each group
图2. 植物乳杆菌GKM3粉对IM诱导肌少症小鼠食物摄入量之影响。结果并无显着差异
3.3. 植物乳杆菌GKM3粉末对肌少症小鼠肌握力之影响
图3为研究诱导肌少症后小鼠自体肌握力之影响,在固定(IM) 7天后可观察小鼠肌握力大幅的降低,此时发现喂食GKM3跟诱导组肌肉萎缩程度没有显著差异如图3(A) (p > 0.05)。将时间观察至十四天会发现小鼠握力逐渐回复如图3(B),这也代表表示持续食用GKM3在肌肉萎缩的情况下,有显著回复部分小鼠肌握力(p < 0.05)。
3.4. 植物乳杆菌GKM3粉末对肌少症小鼠肌耐力之影响
图4为研究诱导肌少症后小鼠自体肌耐力之影响,这是测试小鼠在定速跑步装置上是否能维持一定时间,底端部分有感触电击装置,一旦触碰一次就会记录一次并产生小电流。在固定(IM) 7天后同样可观察小鼠肌耐力大幅的降低,此时发现喂食GKM3跟诱导组肌肉萎缩程度已有显着差异(图4(A))。将时间观察至十四天后发现肌少症诱导组小鼠被电击次数显著增加,代表诱导组的肌耐力更是恶化。相较持续食用GKM3组,有显着回复小鼠肌耐力(图4(B))。
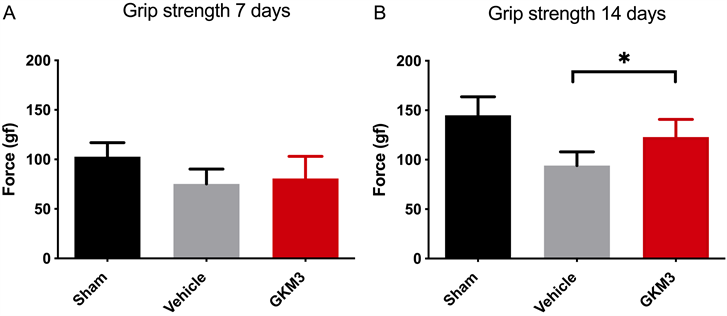
Figure 3. Effect of Lactobacillus plantarum GKM3 powder on mouse (n = 4) grip strength at (A) 7 days (B) 14 days. Values with * symbolmean there is significantly difference (p < 0.05)
图3. 植物乳杆菌GKM3粉末喂食(A) 7天(B) 14天时对小鼠(n = 4)握力的影响。*代表有显著差异(p < 0.05)
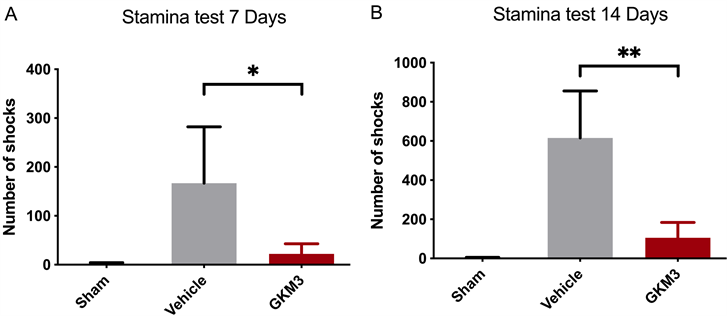
Figure 4. Effect of Lactobacillus plantarum GKM3 powder on mouse (n = 4) staminaat (A) 7 days (B) 14 days. Values with * symbolmean there is significantly difference (p < 0.05), **symbolmeanp value is < 0.01
图4. 植物乳杆菌GKM3粉末喂食(A) 7天(B) 14天时对小鼠(n = 4)肌耐力的影响。*代表有显著差异(p < 0.05),**代表显著差异为p < 0.01
3.5. 植物乳杆菌GKM3粉末对肌少症小鼠腓肠肌及比目鱼肌之影响
图5为植物乳杆菌GKM3粉末对肌少症小鼠腓肠肌及比目鱼肌之影响。在两周动物试验后,实验小鼠经由人道牺牲并取得后腿骨骼肌(分别为腓肠肌及比目鱼肌)进行精准秤重,结果发现相较于诱导肌少症组别,喂食GKM3之腓肠肌重量有显著增加(p < 0.05),而比目鱼肌则是无显著改变(p > 0.05)。
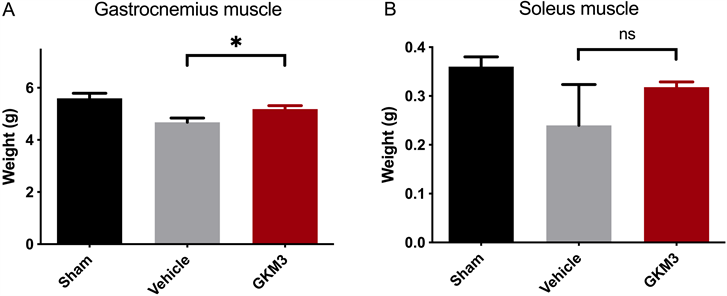
Figure 5. Effect of Lactobacillus plantarum GKM3 powder after 14 days on mouse (n = 4) (A) Gastrocnemius and (B) Soleus muscle mass. Values with * symbolmean there is significantly difference (p < 0.05)
图5. 植物乳杆菌GKM3粉末喂食14天后对小鼠(n = 4) (A) 腓肠肌和(B) 比目鱼肌质量的影响。*代表有显著差异(p < 0.05)
4. 讨论
近期文献提出肠道微生物在维持全身体重,骨骼肌质量(肠肌轴)之间扮演了一个重要角色 [12]。年轻小鼠的肠道菌相在经过抗生素的破坏会造成肌肉的流失 [13],也发现在肌握力上,保持无肠道菌的年轻小鼠肌握力会比有肠道菌的一般年长鼠还来得差 [14]。根据这个概念,学者认为微生物群可通过调节肠道来影响肌肉的结构,如骨骼肌发炎反应,氧化壓力和线粒体功能等 [15]。因此补充益生菌对于延缓肌少症是一种新的健康预防策略。我们在先前研究发现GKM3具有良好的肠道吸附性与96%以上的强耐酸胆盐耐受性,可顺利抵达大鼠小肠并降低高脂肪饮食的吸收而达改善体脂的功效 [10],最终也能降低高脂肪饮食所引起的肠道发炎反应。因此在本次评估GKM3是否也具有增加肌肉量与质之功效,进而达到延缓衰老所衍生的肌少症。
地塞米松(dexamethasone)是一种人工合成的糖皮质激素,常在实验中用于诱导骨骼肌的萎缩,会经由抑制Akt/mTOR合成蛋白质的路径导致肌管分解 [16]。本报告利用小鼠纤维母细胞(C2C12)建立地塞米松(dexamethasone)诱导肌肉萎缩之筛选平台,发现经由GKM3处理过后的分化肌管可抑制地塞米松的伤害,相较没药物处理过的组别,肌管可从原本71.7%恢复到90.8%之正常值。在动物诱导肌少症模式中本次研究使用禁锢小鼠行动力而使其肌肉萎缩,这样的模式优点比起药物诱导或基因改造鼠不会影响到原有的肠道菌相,可以使得测试之素材功效是否真有效更加确定,所以本次试验选用此模式去做素材上的探讨。在动物试验中从表1我们可以发现在小鼠体重上没有显著差异,代表禁锢小鼠的行动力是一种安全的诱导模式。从图2在摄食量虽然禁锢小鼠组别似乎有上升趋势,但统计上并没有显著上的差异,未来可能要提升小鼠数量才能评估这个项目。
在延缓肌少症的研究是希望能增加肌肉量与质之功效,故会在整个实验过程中的第七天以及第十四天分别纪录小鼠的肌握力与耐力。动物实验方式进行诱导达七天禁锢小鼠的行动,以模拟长期卧病在床在所造成肌肉萎缩之环境。接着,卸除IM后再让小鼠恢复行动力达七天来观察诱导肌少症后自身肌肉的恢复状况。从图3可发现在第七天肌握力大幅的衰退约~26.8%,代表诱导是有效果的,接着将时间观察至十四天会发现持续食用GKM3的小鼠握力比起禁锢但无喂食组别,有显著提升~30.5%之肌握力(p < 0.05)。不过此现象还无法回到正常组别水准,可能因观察期太短仅一周,尚不足以完全回复,但可代表在短期内持续食用GKM3是可以有效的延缓肌握力流失。接着在小鼠肌耐力试验中,观察小鼠是否能在斜面跑步装置上有效的维持肌肉的功用,每当小鼠肌耐力不足则会激活底端所安装的电击装置且记录一次。这样,在第七天时没有喂食GKM3组别发现电击纪录约166次,代表平均肌耐力都会比有喂食GKM3的肌耐力来得差(仅22次),且在第十四天时没有喂食GKM3耐力不足的趋势会更加明显,电击次数约615次,这也就代表一旦肌肉萎缩后在没有进行治疗下会更加恶化,符合在临床检查出肌少症所观察到的现象。
最后,实验小鼠在两周后的试验经由人道牺牲并取得后腿骨骼肌(分别为腓肠肌及比目鱼肌)进行精准秤重,结果如图5发现相较于诱导肌少症组别,喂食GKM3之腓肠肌重量有显着增加(p < 0.05),而比目鱼肌则是无显着改变(p > 0.05)。此结果也符合在图三肌握力与图四耐力的结果,由于比目鱼肌并没有显著的恢复,故推测少了比目鱼肌的帮助这可以解释为何无法回复到正常组的肌握力。过去文献中跟耐力较有关连的肌纤维属于红肌类型 [17],实验结果从肌耐力提升可能来自于腓肠肌的红肌部位恢复,但对于GKM3实际作用机制还需后续从分子角度来探讨。普遍认知是益生菌能将纤维和蛋白质在内的一些营养物质更有效率代谢成短链脂肪酸等介体,从而进入全身循环补充肌肉的修复,这可能也是GKM3走的主要机制。
5. 结论
本实验证实,持续14天喂食500 mg/kg传统发酵酸菜分离出植物乳杆菌Lactobacillus plantarum GKM3可有效缓解在肌少症所造成的肌耐力退化及肌肉量流失。从之前研究已指出植物乳杆菌GKM3在大鼠实验中可经由调整肠道菌群降低在高脂肪饮食所造成的发炎反应。在本次实验GKM3可能经由改善C57BL/6J小鼠的肠道菌群形成有效率代谢成短链脂肪酸來补充肌肉的修复。
文章引用
李宗儒,吕庭宇,蔡侑珊,陈炎链,陈劲初. 探讨补充Lactobacillus plantarum GKM3在肌力退化及肌肉流失之功效
The Ameliorative Effect of Lactobacillus plantarum GKM3 on Muscle Atrophy[J]. 食品与营养科学, 2020, 09(04): 309-317. https://doi.org/10.12677/HJFNS.2020.94041
参考文献
- 1. Beaudart, C., Zaaria, M., Pasleau, F., Reginster, J.-Y. and Bruyère, O. (2017) Health Outcomes of Sarcopenia: A Sys-tematic Review and Meta-Analysis. PLoS ONE, 12, e0169548. https://doi.org/10.1371/journal.pone.0169548
- 2. Morley, J.E., Anker, S.D. and von Haehling, S. (2014) Preva-lence, Incidence, and Clinical Impact of Sarcopenia: Facts, Numbers, and Epidemiology-Update 2014. Journal of Ca-chexia, Sarcopenia and Muscle, 5, 253-259. https://doi.org/10.1007/s13539-014-0161-y
- 3. Bianchi, L., Abete, P., Bellelli, G., Bo, M., Cherubini, A., Corica, F., Di Bari, M., et al. (2017) Prevalence and Clinical Correlates of Sarcopenia, Identified According to the EWGSOP Definition and Diagnostic Algorithm, in Hospitalized Older People: The GLISTEN Study. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 72, 1575-1581. https://doi.org/10.1093/gerona/glw343
- 4. Cruz-Jentoft, A.J. and Sayer, A.A. (2019) Sarcopenia. The Lancet, 393, 2636-2646. https://doi.org/10.1016/S0140-6736(19)31138-9
- 5. Hunter, G.R., Singh, H., Carter, S.J., Bryan, D.R. and Fisher, G. (2019) Sarcopenia and Its Implications for Metabolic Health. Journal of Obesity, 2019, Article ID: 8031705. https://doi.org/10.1155/2019/8031705
- 6. Yanai, H. (2015) Nutrition for Sarcopenia. Journal of Clinical Medicine Research, 7, 926-931. https://doi.org/10.14740/jocmr2361w
- 7. Bian, A., Ma, Y., Zhou, X.Z., Guo, Y., Wang, W.Y., Zhang, Y.R. and Wang, X.F. (2020) Association between Sarcopenia and Levels of Growth Hormone and Insulin-Like Growth Factor-1 in the Elderly. BMC Musculoskeletal Disorders, 21, 214. https://doi.org/10.1186/s12891-020-03236-y
- 8. Lahiri, S., Kim, H., Garcia-Perez, I., Reza, M., Martin, K.A., Kundu, P., Cox, L.M., et al. (2019) The Gut Microbiota Influences Skeletal Muscle Mass and Function in Mice. Science Translational Medicine, 11, 502. https://doi.org/10.1126/scitranslmed.aan5662
- 9. Bian, A.-L., Hu, H.-Y., Rong, Y.-D., Wang, J., Wang, J.-X. and Zhou, X.-Z. (2017) A Study on Relationship between Elderly Sarcopenia and Inflammatory Factors IL-6 and TNF-α. European Journal of Medical Research, 22, 25. https://doi.org/10.1186/s40001-017-0266-9
- 10. 林诗伟, 孙至柔, 张维棠, 王启宪, 赵敞, 陈炎炼, 徐庆琳, 陈劲初. 植物乳杆菌GKM3益生菌对高脂饮食肥胖大鼠之影响[J]. 食品与营养科学, 2017, 6(2): 85-95.
- 11. Aihara, M., Hirose, N., Katsuta, W., Saito, F., Maruyama, H. and Hagiwara, H. (2017) A New Model of Skeletal Muscle Atro-phy Induced by Immobilization Using a Hook-and-Loop Fastener in Mice. Journal of Physical Therapy Science, 29, 1779-1783. https://doi.org/10.1589/jpts.29.1779
- 12. Przewłócka, K., Folwarski, M., Kaźmierczak-Siedlecka, K., Skonieczna-Żydecka, K. and JacekKaczor, J. (2020) Gut- Muscle Axis Exists and May Affect Skeletal Muscle Adapta-tion to Training. Nutrients, 12, 1451. https://doi.org/10.3390/nu12051451
- 13. Lustgarten, M.S. (2019) The Role of the Gut Microbiome on Skeletal Muscle Mass and Physical Function: 2019 Update. Frontiers in Physiology, 10, 1435. https://doi.org/10.3389/fphys.2019.01435
- 14. Manickam, R., Oh, H.Y.P., Tan, C.K., Paramalingam, E. and Wahli, W. (2018) Metronidazole Causes Skeletal Muscle Atrophy and Modulates Muscle Chronometabolism. International Journal of Molecular Sciences, 19, 2418. https://doi.org/10.3390/ijms19082418
- 15. Chen, L.-H., Chen, Y.-H., Cheng, K.-C., Chien, T.-Y., Chan, C.-H., Tsao, S.-P. and Huang, H.-Y. (2018) Antiobesity Effect of Lactobacillus Reuteri 263 Associated with Energy Metabo-lism Remodeling of White Adipose Tissue in High-Energy-Diet-Fed Rats. The Journal of Nutritional Biochemistry, 54, 87-94. https://doi.org/10.1016/j.jnutbio.2017.11.004
- 16. Shen, S.N., Liao, Q.W., Liu, J.X., Pan, R., Lee, S.M.-Y. and Lin, L.G. (2019) Myricanol Rescues Dexamethasone- Induced Muscle Dysfunction via a Sirtuin 1-Dependent Mechanism. Journal of Cachexia, Sarcopenia and Muscle, 10, 429-444. https://doi.org/10.1002/jcsm.12393
- 17. Talbot, J. and Maves, L. (2016) Skeletal Muscle Fiber Type: Using Insights from Muscle Developmental Biology to Dissect Targets for Susceptibility and Resistance to Muscle Disease. Wiley Interdisciplinary Reviews. Developmental Biology, 5, 518-534. https://doi.org/10.1002/wdev.230
NOTES
*通讯作者。
