Optoelectronics
Vol.06 No.02(2016), Article ID:17829,9
pages
10.12677/OE.2016.62011
The Application Situation of Femtosecond Laser in Biology
Zhijun Wu
First Affiliated Hospital of Henan University of Science and Technology, Luoyang Henan

Received: May 30th, 2016; accepted: Jun. 18th, 2016; published: Jun. 21st, 2016
Copyright © 2016 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Lots of great progress had been made in the application of Biology by femtosecond laser due to its ultra-short time scale and ultra high peak power density. Many researches have being more and more interest in studying the mechanisms of femtosecond laser interaction with biological tissues and done much breakthrough. This article introduces applications of femtosecond laser in biology, including laser bioeffect, ablation of organelles in living cells, multiphoton lithography, cell imaging, etc. Finally, the prospect of femtosecond laser nanosurgery is discussed.
Keywords:Femtosecond Laser, Laser Biology, Cell Imaging, Cell-Surgery

飞秒激光在生物学方面的应用情况
吴志军
河南科技大学第一附属医院,河南 洛阳

收稿日期:2016年5月30日;录用日期:2016年6月18日;发布日期:2016年6月21日

摘 要
飞秒激光由于其超快时间特性和超高值功率特性在生物学应用领域取得了重大的成功,飞秒激光与生物材料作用的机理研究引起了众多学者的浓厚兴趣,通过近数十年的研究已经得到了突破性的进展。本文综述了飞秒在现代生物学领域中的一些应用,包括激光生物效应、活细胞微手术、直写微纳加工应用、细胞成像等。最后对飞秒激光的应用前景做了简要预测。
关键词 :飞秒激光,激光生物学,细胞成像,细胞手术

1. 飞秒激光特点
1960年7月,美国人Mahaan博士研究出世界上第一台激光器(红宝石激光器)。激光作为一种新型的光源具有以往光源所不具有的一系列优点,如高强度、高方向性、高单色性、高相干性。此后,激光技术得到了飞速发展,其中一个重要方向就是向输出脉宽越来越窄的脉冲方向发展。到目前为止,脉冲持续时间已由纳秒(ns)、皮秒(ps)压缩至飞秒(fs),甚至至阿秒(as)级。故飞秒激光的脉冲持续时间远短于热平衡时间(10−12 s数量级),所以在与物质作用时,飞秒激光注入的能量被集中在一个空间极小的范围内,其能量几乎不会被传递到直接作用区以外,对作用区周围的热影响极小。由于聚焦激光的焦斑尺寸极小,能量密度极高,能量的利用率亦大大提高。这使得被作用区域的温度在极短时间内升到极高,远超过材料的液化和气化温度,促使物质发生高度电离,达到等离子态。同时,由于飞秒激光的强度在空间上一般呈高斯分布,即激光焦斑中心强度最大,而随着向边缘的过渡其强度逐渐减弱,因此,飞秒激光能在极短的时间、极小的空间和极端的物理条件下对生物细胞进行作用。本文综述了激光的生物效应和飞秒激光在生物学领域的具体应用。
2. 激光生物效应
激光生物效应一般是指激光作用于生物组织可能产生的物理的、化学的或生物的反应。生物组织吸收激光能量后,可能会发生一系列能量转换过程,其中包括:由光能转化成热能、机械能、化学能、生命物质的内能和生物刺激能,分别对应于激光的五种光生物效应:光热效应、机械效应、光化效应、电磁效应以及低强度激光对生物组织的刺激效应。转换的能量进一步作用于生物组织,使生物组织在细胞分子或系统上发生机能性或形态学上的变化。根据这些不同的生物效应,激光可应用于医学研究、诊断和治疗 [1] 。
a) 激光生物热效应
激光频率与受照生物组织分子的振动频率相等或相近时,会使分子振动加强,与其他分子的碰撞频率就会增加,生物体的局部会温度升高,光能转化为分子的动能后变成热能。温度超过一定阈值,将会造成蛋白质变性,生物组织表面收缩、脱水、组织内部因水分蒸发而受到破坏,造成组织凝固坏死,当局部温度急剧上升达几百度甚至上千度时,可以造成照射部分碳化或汽化 [2] 。此过程称为激光生物热效应,是激光作用生物组织最常见的生物效应。
在医学临床治疗时常会利用激光的热效应来凝固、汽化或碳化生物组织。脉冲染料激光血管内照射作用于微血管上皮细胞来治疗瘢痕,就是利用了光热效应的热致凝固效应。微血管中的血红蛋白吸收激光,通过组织细胞的热传导凝固损伤微血管,使血管退行萎缩,从而达到治疗瘢痕的目的。采用氩离子激光治疗雀斑等色素性疾病和去除表皮皮肤的细小皱纹的光子嫩肤技术,就是利用激光光热效应碳化表皮皮肤细胞和含色素的病理性细胞,受碳化的细胞坏死凋亡,人体新陈代谢修复生成新的细胞从而达到美容效果。采用超脉冲CO2激光或Er:YAG激光光热效应汽化面部表皮增生性瘢痕和浅表细纹来整容或美容,为了达到最佳作用效果和最低的损伤,临床上常将两种激光结合起来使用,先用超脉冲CO2激光作大面积去皱后,再用Er:YAG激光做精细修整,并且热损伤和机械损伤小,联合使用可以产生优于单一波长的医疗效果。这种激光的热致汽化作用也已应用于医学临床的皮肤整形美容科 [3] 。
b) 激光生物机械效应
由于光子本身就具有一定的质量、动量和能量等属性,当激光照射生物组织时,光子把自身的动量传给吸收体,光子与受照对象物质相互碰撞时会对受照体施以压力,此压力即为光压,是激光本身的辐射压力直接对生物组织产生的压强,称作一次压强。当巨脉冲和超短脉冲激光照射生物组织,对其作用时间极短,光能量密度集中,功率密度可以达到1015 W/cm2量级,会在生物组织中产生106℃量级的高温、1011 Pa量级的高压以及104 V/cm量级的高电磁强度等特殊效应,这些高温、高压和强电磁场效应继发作用引起气流反冲压、内部汽化压、热膨胀超生压、热致等离子体以及因激光的强电场继发作用引起的电致伸缩压等,叫二次压强。激光对生物组织细胞的压强可以改变生物组织细胞的形状和生理学状态,主要是由二次压强产生的机械力起作用 [1] 。
在临床上,利用激光引起的压强作用可治疗多种疾病,等离子体膨胀产生的冲击波可应用于激光眼科手术及激光碎石术。如眼科中的压力打孔以及用脉冲染料激光和调Q Nd:YAG激光在结石表面或在结石的周围灌洗液中形成等离子体所产生的高压冲击波击碎结石。
c) 激光生物光化效应
激光生物光化效应又称激光生物光化反应,是指在激光的作用下,生物物质产生理化反应。生物物质之所以能生长发育、修复和繁育等,其中生化反应是主要因素之一。激光生物光化反应可分为原初光化反应和继发光化反应两个阶段,当一个处于基态的生物分子吸收一个或多个光子能量以后,受激跃迁到某一激发状态,在它从激发态返回到基态,但又不返回到原来的能量状态的驰豫过程中,多出来的能量消耗在本身化学键断裂或形成新键上,其发生的化学反应称为原初光化反应。通常在此过程中会形成大多数具有高度化学活性的中间产物,如自由基、离子或其他不稳定的产物。这些极不稳定的中间产物继续进行化学反应直至形成稳定产物,这种光化反应称为继发光化反应,前后两种反应组成了一个完整的光化反应过程,其中继发光化学反应在有光或无光的环境中均可发生。整个光化学反应的过程大致可分为光致分解、光致氧化、光致聚合及光致敏化四种主要类型。光致敏化效应又包括光动力作用和一般光敏化作用 [1] 。
应用光敏剂进行的光动力学疗法是光化效应的典型应用。在机体内注射某种光敏物质,光敏剂被肿瘤细胞和病理性增生组织所吸收,而正常细胞吸收的光敏物质很少,病变组织内的光敏剂含量远大于正常组织。生物组织在受到近紫外和可见光的照射下,积存于病变组织中的光敏剂经光照激发,会象催化剂那样可反复不断地敏化产生光氧化作用破坏肿瘤和病变性组织分子和细胞,破坏肿瘤组织内的微血管循环系统。生物体系中的变化是敏化剂引发的光氧化过程的结果,通过生物光敏化作用来损伤肿瘤和其它病理性增生组织而达到治疗目的称为光动力疗法。光动力学疗法可选择性地破坏肿瘤组织和病理性组织,对正常组织损伤小,所以它是一种较好的治疗方法,尤其对研究、诊断和治疗。
d) 激光生物电磁效应
激光是一种电磁波,激光与生物组织相互作用实质上是电磁场与生物组织相互作用,在这种作用中主要是电场起作用,强电场会导致生物分子发生激励、振动、高温、高压和共振等作用,引起生物组织损伤,促使自由基增加;同时也会影响酶的活性,使酶活化,提高生理生化反应速度。这种高功率密度激光作用于生物组织会引起生物组织变化的效应就称为激光电磁效应。
当激光照射人体组织时,相当于将人体置于强大的电场中。而人体类似于电介质电容器,电介质中整个分子呈中性,但中性分子的电荷分布不均衡,正负电荷的电中心重合的为非极性分子,正负电荷的电中心不重合的为极性分子。在电场作用下,非极性分子的正负电荷分别朝相反方向运动,使分子发生极化,被极化的分子在电场作用下将重新排列,在重排过程中与周围分子(粒子)发生碰撞摩擦而产生大量的热。这种电磁场效应引起或改变生物组织分子及原子的量子化运动,引起生物组织发生一系列的变化,据此可用于多种生物医学作用 [1] 。
e) 激光生物刺激效应
临床实践表明弱激光作用于生物组织时,不对生物组织直接造成不可逆的损伤,而是会产生某种与超声波、针灸、艾灸等机械的和热的物理因子所获得的生物刺激相类似的某些应答性反应,这种效应叫作激光生物刺激效应。生物体对这种刺激的某些应答性反应可能是兴奋,也可能是抑制,由激光和生物体两者性质而定。这种刺激可引起机体的免疫功能,血液循环、血红蛋白合成、糜蛋白酶活性及白细胞噬菌作用等的应答性反应,在合适的条件下,这种应答性反应是有益的,它有利于生物的生存和延续。
3. 飞秒激光在生物方面的应用
a) 飞秒激光在活细胞微手术中的应用
飞秒激光在材料科学领域所表现出来的微纳加工和处理优势在生命科学方面同样适用,其在生物体内所能实现的三维精确微创手术为医学领域的发展提供了新的机会。在对细胞和组织的处理和切除方面,飞秒激光已逐渐成为一个重要的工具,并取得了很多令人振奋的实验结果。
Ø 飞秒激光亚细胞器手术
为了研究细胞的生长、运动、新陈代谢、有丝分裂、分化和凋亡等行为,需要对细胞内的细胞骨架或细胞器进行处理,传统的工具由于空间分辨率不高且对细胞损伤较大制约着该领域的发展,飞秒激光的出现无疑为该领域注入了新的活力。
2006年哈佛大学hmar等人采用飞秒激光手术在活细胞内切割了单根肌动蛋白丝,研究其收缩动力学及细胞形状的变化,如图1所示。日本大阪大学采用飞秒激光在活的NIH3T3细胞内切割了单根肌动蛋白丝,发现切割后十分钟后,断裂的肌动蛋白丝重新愈合 [4] ,从而实现了对细胞内纤维解聚和组装的人为调控,为各种细胞内动力学过程的研究奠定了基础。
大阪大学用飞秒激光手术在海拉细胞中实现了单个线粒体的蚀除,而没有破坏细胞周围其它结构,实验后12小时,被手术的细胞进行了正常的有丝分裂 [5] 。德国耶拿大学的TirlaPur等人用飞秒激光在植物细胞里实现了半个叶绿体的蚀除,应用80 MHz钦篮宝石激光对人类的染色体进行点蚀除和线切割,同时应用原子力显微镜对细胞进行观察 [6] 。
Ø 飞秒激光细胞膜手术
由脂和蛋白质分子构成的细胞膜是防止细胞外物质进入细胞的屏障,它保证了细胞细胞内环境的相对稳定,使各种生化反应能够有序进行。细胞膜的流动性不仅是膜的基本特性之一,也是细胞进行生命活动的必要条件。通过膜脂质流动性的改变可反应出细胞膜的功能状态及膜受损伤的程度,同时,膜的流动性也决定了其具有自动愈合的能力。细胞膜与飞秒激光结合具有广泛的应用前景,如细胞融合、细胞分离、转基因、辅助受精等。
2002年,Tirlapur等人用钦蓝宝石飞秒激光器产生的飞秒激光在细胞膜上产生单个的!特定位置的瞬时穿孔,允许DNA通过并保存了细胞的完整性 [6] 。
2005年,Kohil等人用飞秒激光对哺乳动物细胞进行亚微米细胞膜切割和细胞分离,并保持了细胞的活性 [7] 。2008年,天津大学的王清月等人用波长800 nm,脉宽40 fs的飞秒激光对酵母细胞进行融合,同时用CCD检测细胞的融合过程,靶细胞在手术160分钟后成功实现了细胞融合 [8] ,如图2所示。
Ø 飞秒激光生物活体手术

Figure 1. Fluoresent images for dissection of action stress fiber: before (a), Several seconds after (b), 18 mins after (c) and 40 mins after (d), where the white circles show the cutting position
图1. 肌动蛋白丝的荧光照片,白色圆圈表示激光切割部位。(a) 激光切割前;(b) 切割数秒后;(c) 切割后18 min;(d) 切割后40 min

Figure 2. Photographs of video frames of the cell fusion. (a) before fusion; (b) About 23 mins postfusion; (c) About 90 mins postfusion; (d) About 160 mins postfusion
图2. 细胞融合过程。(a) 融合前;(b) 融合后23 min;(c) 融合后90 min;(d) 融合后160 min
生物活体是一个复杂开放的系统,其内部存在着物质!能量和信息的持续不断的变换。在活体的环境开展研究无疑是对医学技术水平的一大挑战。飞秒激光作为一项新兴技术,自产生以来对生物活体的研究就非常受人们的重视。
国内外学者利用飞秒激光在生物活体上开展了大量的研究工作,其中最为成熟并在临床上有应用的是飞秒激光角膜屈光手术和角膜移植手术,该技术的应用使手术本身更安全并且术后视觉质量恢复的更好,此外还有不少的研究停留在实验阶段,如斯坦福大学Ginzton实验室 [9] 使用飞秒激光对线虫的轴突进行外科手术,手术后这些轴突实现了功能性再生,采用飞秒激光手术对细胞和组织的修正和切除在生物和医学领域逐渐成为一个重要的工具,在神经损伤再生、组织病变的诊断和治疗、皮肤美容等方面无疑都具有一定的应用前景(图3)。
b) 飞秒激光直写微纳加工应用
飞秒激光微纳加工,概括来讲,其实现是基于紧聚焦超短激光脉冲(飞秒量级)的高能量密度光焦点内与物质发生的非线性作用,例如,多光子吸收引起的材料聚合、还原、相变、烧蚀、化学键断裂等。通过计算机控制飞秒激光焦点在目标材料表面或内部的二维和三维直写扫描,完成微纳精度的材料加工与成型,如图4所示。飞秒激光微纳直写技术在很多场合,也被称为多光子光刻加工技术。
哈佛大学Mazur教授课题组,以多光子吸收和碰撞离化理论为基础,提出飞秒激光在玻璃和蓝宝石等透明介质内的激光诱导微爆炸模型,并将该现象用于实现三维光存储 [11] [12] 。吉林大学

Figure 3. Femtosecond laser axotomy in Caenorhabditis elegans worms. Fluorescence images of axons labeled with green fluorescent protein before, immediately after, and in the hours following axotomy. Arrow indicates point of severance. Scale bar, 5 µm
图3. 飞秒激光线虫轴突手术,用绿色荧光蛋白标记的神经轴突实验前后荧光图像,箭头指向断裂点,标尺长5 µm

Figure 4. Schematic diagram of femtosecond laser direct writing process [10]
图4. 飞秒激光直写加工示意图 [10]
用飞秒激光在玻璃内部诱导产生的缺陷中心可发出较强荧光的现象,将飞秒激光微纳加工技术用于三维光存储,并通过荧光读出机制实现了1012 Bit/cm3超高存储密度 [13] 。浙江大学
c) 飞秒激光应用于生物成像
将飞秒激光应用于生物样品成像,主要是通过多光子荧光显微镜来实现。双光子荧光显微成像技术的出现使得对较厚的生物组织进行生物显微成像成为可能。与激光共聚焦显微镜不同的是,双光子荧光显微成像技术利用近红外的飞秒激光作为光源而非利用紫外光源。而且双光子吸收的非线性本质使得双光子荧光显微成像技术无需共焦小孔的加入,与传统的单光子激光共聚焦显微镜相比,双光子荧光显微成像技术具有以下几个优点 [18] [19] :① 成像深度大:可见光或近红外光比紫外光的穿透性强,一般情况下,共聚焦荧光显微成像技术的成像深度只能达到50 µm左右,而双光子显微成像技术的成像深度可达1600 µm,共聚焦和双光子荧光显微成像技术原理如图5所示;② 光损伤小:双光子荧光显微镜的激励源使用可见光或者近红外光,它们对生物活体组织的光损伤小,因此可以对样品进行长时间的科学研究;③ 空间分辨率和对比度高:由于在双光子显微成像中,荧光只有在焦平面很小的区域内产生,焦点外无荧光产生,背景荧光影响小;④ 光漂白区很小:焦点外不发生漂白现象。⑤ 荧光收集率高:双光子显微成像无需共焦小孔的加入,因此荧光收集效率大大提高;⑥ 对探测光路的要求低:对于双光子显微成像而言,发射荧光的波长值与激发光相差很大,因此对探测收集系统的要求比单光子共焦显微镜低;⑦ 适合多标记复合成像:由于很多染料荧光探针的双光子激发光谱比较宽,多种探针可以同时被单一波长的激发光激发,进而得到同一样品的不同信息。但是,荧光标记技术会导致细胞死亡,这是此项技术的一大缺陷。除此之外,成本昂贵也限制了双光子荧光显微成像技术在生物、化学等各个领域的应用。
K. Schenke-Layland等 [18] 用多光子成像来分析细胞外基质成分(如肺部和大动脉心瓣膜的胶原质、弹性蛋白)的结构特点。实验结果表明利用近红外波段飞秒激光的多光子成像可能成为对心脏血管进行无损检测和表征的有力工具。
P. Vérant等 [19] 用双光子荧光显微镜得到了老鼠大脑皮层的血液体积。他们将荧光染料注入循环血液用于血管成像,包括毛细血管的成像,成像深度可达到大脑表面脑膜下400 µm,血液体积由每个深度的荧光归一化计算得到。这种方法既快速,又对背景噪声的敏感度极弱。它的用途可扩展到测量血管的泄露物。
如图6所示,为一套双光子荧光显微成像系统 [20] 。掺钛蓝宝石飞秒激光器振荡级Tsunami发出的激光入射到分束片被分束片分成两束,一束用多模光纤与光谱仪连接,从而监控激光器的工作状态。另一束入射到IX71生物显微镜,经过二向色镜后被物镜聚焦用于激励样品。前向透射光被聚光镜收集后被光电二极管收集,光电二极管输出的信号由数据采集卡采集后送入计算机后进行透射成像。后向出射光被物镜收集后,通过二向色镜将基频光与荧光分开,再通过发射滤波片被光电倍增管进行探测采集,光电倍增管输出的信号由数据采集卡采集后送入计算机进行双光子荧光显微成像。此外,计算机还通过控制器向平移台发送移动命令,从而实现扫描。
4. 结论
通过介绍飞秒激光在在细胞微手术、微纳加工和细胞组织成像等领域中的应用实例,证明飞秒激光
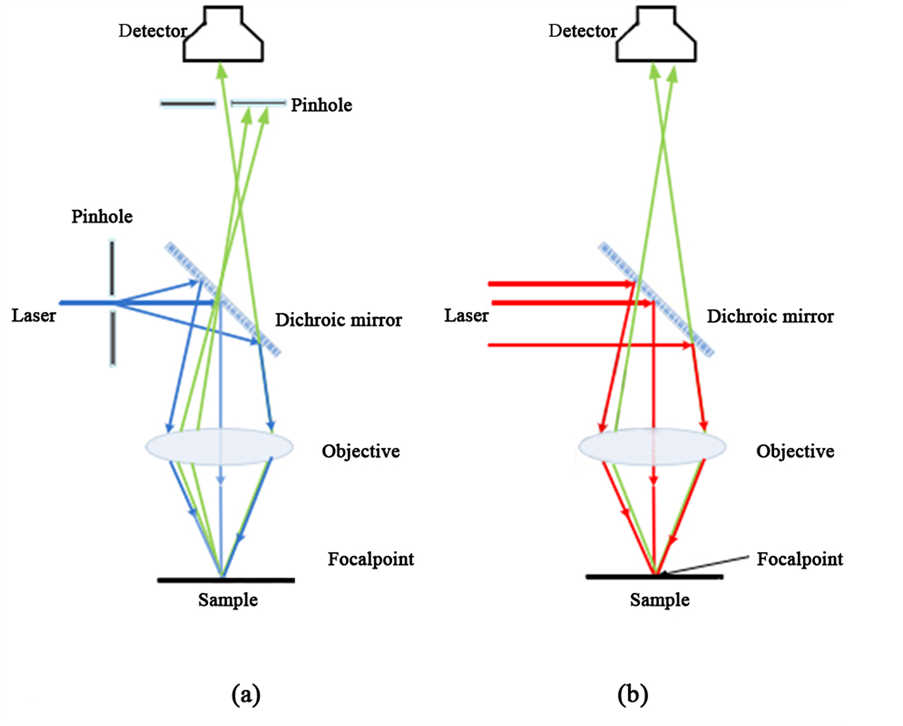
Figure 5. The technology schematic diagram of confocal (a) and two-photon (b) fluorescence microscopy
图5. 共聚焦(a)和双光子(b)荧光显微成像技术原理图
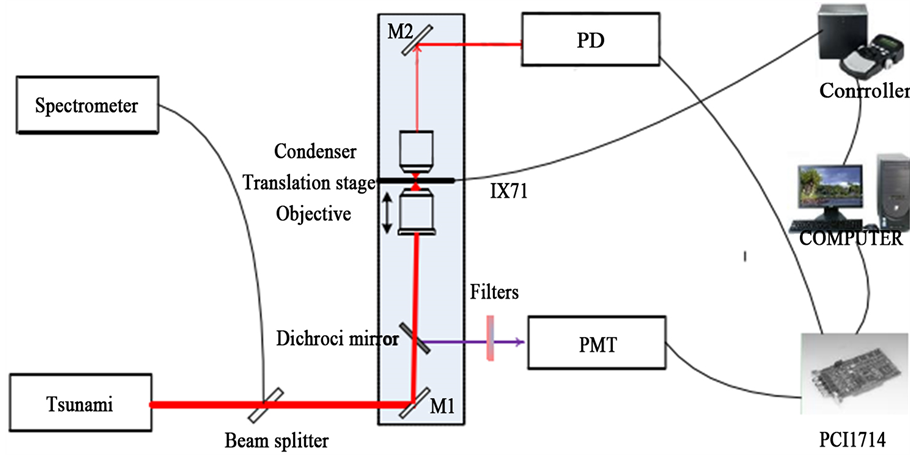
Figure 6. Experimental configurations schematic diagram of imaging system [20]
图6. 成像系统实验装置示意图 [20]
在生物学中的应用前景将更为广阔。尽管飞秒激光手术具有如此大的优越性,但在实际的临床中应用还比较少,主要由于飞秒激光器还存在稳定性、价格昂贵、结构庞大、可操作性差和对特殊生物组织的可复性损伤阈值问题等,需要进一步改进和完善。
文章引用
吴志军. 飞秒激光在生物学方面的应用情况
The Application Situation of Femtosecond Laser in Biology[J]. 光电子, 2016, 06(02): 66-74. http://dx.doi.org/10.12677/OE.2016.62011
参考文献 (References)
- 1. 徐国祥. 激光医学[M]. 北京: 人民卫生出版社, 1998: 101-129.
- 2. 杨继庆, 刘鲁伟, 文峻, 等. 激光生物组织热作用的影响因素[J]. 激光杂志, 2005, 26(5): 94.
- 3. 李海涛. 低强度双波长激光治疗仪的研制和激光照射对巨噬细胞功能影响的实验研究[D]: [硕士学位论文]. 西安: 第四军医大学, 2008.
- 4. Yasukuni, R., Spitz, J.A., Meallet-Renault, R., Negishi, T., Tada, T., Hosokawa, Y., Asahi, T., Shukunami, C., Hiraki, Y. and Masuhara, H. (2007) Realignment Process of Actin Stress Fibers in Single Living Cells Studied by Focused Femtosecond Laser Irradiation. Applied Surface Science, 253, 6416-6419. http://dx.doi.org/10.1016/j.apsusc.2007.01.047
- 5. Konig, K., Riemann, I. and Fritzsche, W. (2001) Nanodissection of Human Chromosomes with Near-Infrared Femtosecond Laser Pulses. Optics Letters, 26, 819-821. http://dx.doi.org/10.1364/OL.26.000819
- 6. Tirlapur, U.K. and Konig, K. (2002) Targeted Transfection by Femtosecond Laser. Nature, 418, 290-291. http://dx.doi.org/10.1038/418290a
- 7. Kohli, V., Elezzabi, A.Y. and Acker, J.P. (2005) Cell Nanosurgery Using Ultrashort(Femtosecond) Laser Pulses: Applications to Membrane Surgery and Cell Isolation. Laser in Surgery and Medicine, 37, 227-230. http://dx.doi.org/10.1002/lsm.20220
- 8. Gong, J.X., Zhao, X.M., Xing, Q.R., Li, F., Li, H.Y., Chai, L., Wang, Q.Y. and Zheltikov, A. (2008) Femtosecond Laser-Induced Cell Fusion. Applied Physics Letters, 92, 1-3. http://dx.doi.org/10.1063/1.2890070
- 9. Yanik, M.F., Cinar, H., Cinar, H.N., Chisholm, A.D., Jin, Y. and Ben-Yakar, A. (2004) Functional Regeneration after Laser Axotomy. Nature, 432, 822. http://dx.doi.org/10.1038/432822a
- 10. 孙允陆. 蛋白质微纳光子器件的飞秒激光直写与特性研究[D]: [博士学位论文]. 吉林: 吉林大学, 2015.
- 11. Glezer, E.N., Milosavljevic, M., Huang, L., et al. (1996) Three-Dimensional Optical Storage inside Transparent Materials. Optics Letters, 21, 2023-2025. http://dx.doi.org/10.1364/OL.21.002023
- 12. Sundaram, S.K., Schaffer, C.B. and Mazur, E. (2003) Microexplosions Intellurite Glasses. Applied Physics A, 76, 379- 384.
- 13. Watanabe, M., Juodkazis, S., Sun, H.B., et al. (2000) Two-Photon Readout of Three-Dimensional Memory in Silica. Applied Physics Letters, 77, 13-15. http://dx.doi.org/10.1063/1.126861
- 14. Qiu, J.R., Jiang, X.W., Zhu, C.S., et al. (2004) Manipulation of Gold Nanoparticles inside Transparent Materials. Angewandte Chemie International Edition, 43, 2230-2234. http://dx.doi.org/10.1002/anie.200352380
- 15. Kanehira, S., Si, J.H., Qiu, J.R., et al. (2005) Periodic Nanovoid Structures via Femtosecond Laser Irradiation. Nano Letters, 5, 1591-1595. http://dx.doi.org/10.1021/nl0510154
- 16. Cheng, Y., Sugioka, K. and Midorikawa, K. (2004) Microfluidic Laser Embedded in Glass by Three-Dimensional Femtosecond Laser Microprocessing. Optics Letters, 29, 2007-2009. http://dx.doi.org/10.1364/OL.29.002007
- 17. Wu, D., Wu, S.Z., Xu, J., et al. (2014) Hybrid Femtosecond Laser Microfabrication to Achieve True 3D Glass/Polymer Composite Biochips with Multiscale Features and High Performance: The Concept of Ship-in-a-Bottle Biochip. Laser & Photonics Reveiws, 8, 458-467. http://dx.doi.org/10.1002/lpor.201400005
- 18. Schenke-Layland, K., Riemann, I., Stock, U.A. et al. (2005) Imaging of Cardiovascular Structures Using Near-Infrared Femtosecond Multiphoton Laser Scanning Microscopy. Journal of Biomedical Optics, 10, Article ID: 024017. http://dx.doi.org/10.1117/1.1896966
- 19. Vérant, P., Serduc, R., Coles, J.A., et al. (2004) A Method for Measuring Cerebral Blood Volume of Mouse Using Multiphoton Laser Scanning Microscopy. SPIE, 5463, 1-12.
- 20. 李茜. 飞秒激光双光子荧光生物显微成像研究[D]: [硕士学位论文]. 黑龙江: 哈尔滨工业大学, 2014.