World Journal of Forestry
Vol.05 No.04(2016), Article ID:18770,9
pages
10.12677/WJF.2016.54012
Identification and Sequence Analysis of β-D-Xylosidase Gene from Citrus grandis var. Shatinyu Hort
Xinmei Qin, Yu Han, Danni Guo, Yujie Liu, Huimin Li, Xinmin Qin*
College of Life Science, Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection (Ministry of Education), Guangxi Normal University, Guilin Guangxi

Received: Oct. 2nd, 2016; accepted: Oct. 16th, 2016; published: Oct. 21st, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
β-D-Xylosidase gene was identified from the transcriptome of the self-pollinated style and cross- pollinated style of Citrus grandis var. Shatinyu Hort. It is 2647 bp (GenBank accession number: KU925841) in length with an open reading frame (ORF) of 2385 bp, encoding 794 amino acids with deduced molecular weight of 87.30 kDa, and theoretical pI value of 5.87. Bioinformatics analysis showed that β-D-Xylosidase is a hydrophilic protein, and contained a same conserved CAS structure domain with the glycosyl hydrolase family. The expression of β-D-Xylosidase gene in unfertilized style was 0.07. in 1 - 3 day self-pollinated styles were 43.13, 27.84 and 1.95 respectively. Whereas, the expression of β-D-Xylosidase gene in 1 - 3 day cross-pollinated styles were 33.90, 76.14 and 49.63 respectively. Phylogenetic analysis revealed that β-D-Xylosidase showed closer kinship with that of Citrus sinensis and Citrus clementina, indicating that they belong to the same evolutionary branch.
Keywords:Citrus grandis var. Shatinyu Hort, β-D-Xylosidase Gene, Sequence Analysis

沙田柚β-D-木糖苷酶基因的鉴定及序列分析
覃信梅,韩愈,郭丹妮,刘玉洁,李惠敏,秦新民*
广西师范大学生命科学学院,珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林

收稿日期:2016年10月2日;录用日期:2016年10月16日;发布日期:2016年10月21日

摘 要
从沙田柚自交和异交花柱转录组测序中鉴定了β-D-木糖苷酶基因序列。该基因全长为2647 bp (GenBank登录号为KU925841),开放阅读框(ORF)为2385 bp,共编码794个氨基酸,编码的蛋白质的分子量为87.30 kDa,理论等电点为5.87。β-D-木糖苷酶基因编码蛋白为亲水性蛋白,含有1个与糖基水解酶家族蛋白相同的保守CAS结构域。β-D-木糖苷酶基因在沙田柚在未授粉花柱中的表达量(RPKM)为0.07,自花授粉1、2、3 d花柱中的表达量(RPKM)分别为43.13、27.84、1.95,在异花授粉1、2、3 d花柱中基因的表达量(RPKM)则分别为33.90、76.14和49.63。系统进化树显示沙田柚β-D-木糖苷酶与甜橙(Citrus sinensis, XM_006468131)和克莱门柚(Citrus clementina, XM_006449591)亲缘关系很近,属于同一进化分支。
关键词 :沙田柚,β-D-木糖苷酶基因,序列分析

1. 引言
β-D-木糖苷酶(EC 3.2.1.37)是木聚糖酶系的重要组成成分,是降解细胞壁半纤维素中阿拉伯木聚糖和木聚糖残基的主要酶。它主要是从非还原末端把木二糖和低聚木糖催化切割为木糖单体 [1] ,解除产物对内切木聚糖酶的抑制和对木聚糖水解的限制,是半纤维素降解过程中的限速酶 [2] 。1991年Herissat等 [3] 根据氨基酸序列的相似性将糖基水解酶编为不同的家族,不同来源的β-木糖苷酶分别归属于第3、39、43、52和54家族,由真菌和高等植物产生的β-木糖苷酶大都属于第3家族。目前,β-木糖苷酶可以从多种微生物和一些植物中分离,并且在能源、工农业废物处理、造纸、医药等领域到广泛应用 [4] [5] 。
自交不亲和性(self-incompatibility, SI)是植物界的一种普遍现象,广泛存在于被子植物中。所谓自交不亲和性是指能产生具有正常功能且同期成熟的雌雄配子的雌雄同体植物,虽然雌蕊的柱头或花柱可以识别自体或异体花粉,却抑制自体花粉萌发或生长的一种特性,在被子植物的有性生殖过程中自交不亲和性对于避免近亲繁殖有很重要的作用 [6] 。沙田柚为无患子目(Sapindales)、芸香科(Rutaceae)、柑橘属(Citrus)植物。目前,关于芸香科植物的自交不亲和性机理尚不明确,但沙田柚在自交不亲和的形态学、细胞学和蛋白质化学等方面的研究取得了一定进展:确定了沙田柚属于配子体自交不亲和,花粉管在花柱中生长受抑制的部位是在花柱的1/2左右 [7] ,已鉴定出了沙田柚自交花柱特异蛋白,并测定了该蛋白的分子量、等电点和N-末端氨基酸序列 [8] [9] 。秦新民等 [10] 对沙田柚花粉管特异蛋白进行了分离和鉴定,确定了花粉管中的特异蛋白的产生部位及分布 [11] [12] 。同时,花柱通道细胞中的特异蛋白的产生部位及分布也得到确定 [13] 。
β-D-木糖苷酶在植物体内的生理功能的研究报道不多,而该酶与植物授粉和自交不亲和性的研究尚未见报道。我们从沙田柚花柱转录组测序结果中鉴定了1个β-D-木糖苷酶基因序列,对该基因编码的蛋白质进行了生物化学特征分析。并通过该基因在授粉前后,以及自交和异交花柱中表达差异情况,初步探讨了β-D-木糖苷酶基因在沙田柚授粉以及自交不亲和过程中的生理功能。
2. 材料与方法
2.1. 材料
沙田柚实验材料采自广西灵川县潮田乡大山口村果园十年生结果树。在盛花期对沙田柚样树进行人工自交(沙田柚X沙田柚)授粉和异交授粉(酸柚X沙田柚),3 d后分别收集自交和异交1~3 d的授粉花柱,以及当天开花的未授粉花柱,立即放入液氮中速冻,并保存于−80℃超低温冰箱备用。
2.2. 方法
2.2.1. RNA的提取,建库和测序
总RNA的提取按改良Trizol法进行 [14] ,建库和测序参考文献 [15] 。
2.2.2. 序列分析和系统树构建
使用DNAman、Finder、TMPRED、SWISS-MODEL、NetPhos2.0、SignaIP4.1等软件进行序列的开放阅读框(ORF)、编码氨基酸、编码蛋白的理化分析。将测定的基因序列与GenBank中的12种植物的同源序列进行比对,基于氨基酸序列β-D-木糖苷酶基因的系统进化树用DNAman软件进行构树。系统发育树的构建方法参考文献 [16] 。
2.2.3. 基因表达量及差异统计
使用RPKM法(Reads per kb per million reads),即每百万resd中来自某一基因每千碱基长度的resd数目)计算基因表达量。如果一个基因存在多个转录本,则用该基因的最长转录本计算其测序覆盖度和表达量。根据基因的表达量(RPKM值)计算该基因在不同样本间差异表达倍数。FDR (False Discovery Rate)值越小,异倍数越大,表明表达差异越显著。本文确定FDR ≤ 0.001且差异表达倍数不低于2倍(log2Ratio ≥ 1)的条件对基因进行差异表达统计。
3. 结果与分析
3.1. 基因的生物信息学分析
β-D-木糖苷酶基因(CL5107.Contig3_All)的全长序列2647 bp (GenBank登录号为KU925841),使用NCBI网站上的NCBI ORF Finder和生物信息学软DNAman进行分析,该序列包含一个2385 bp的开放阅读框(ORF),编码794个氨基酸(图1)。
3.2. 编码蛋白质的分析和疏水性预测
通过DNAman软件分析,该基因编码的蛋白质分子量(MW)为87.30 kDa,等电点pI为5.87。蛋白质序列的疏水性分析见图2,从图中可以看出所编码的肽链中疏水性最大值约为3.73,最小值约为−3.09,属于亲水性蛋白。
运用在线分析软件(http://www.expasy.org/tools/protparam.html)分析可知,该蛋白质带负电荷的氨基酸(Asp + Glu)总数为83,带正电荷的氨基酸(Arg + Lys)总数为75;分子是为C3914H6076N1160O561S34;不稳定系数为26.77,属于稳定性的蛋白质。
3.3. 功能结构域分析
将编码的氨基酸序列用NCBI的Conserved Domain Architecture Retrieval Tool分析,发现该蛋白质具有1个与糖基水解酶家族(Glycosyl hydrolase family)蛋白相同的保守CAS结构域(图3)。
 注:开放阅读框从氨基酸(M)开始至终止密码(*)止
注:开放阅读框从氨基酸(M)开始至终止密码(*)止
Figure 1. Nucleotide sequence of β-D-Xylosidase gene and the deduced amino acid sequence
图1. β-D-木糖苷酶基因序列和推测的氨基酸序列
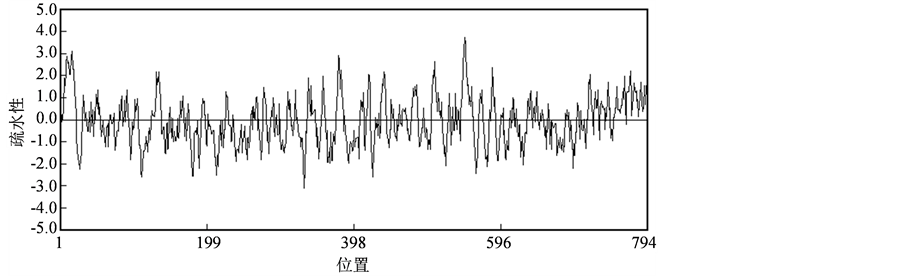
Figure 2. Hydrophobicity Analysing of β-D-Xylosidase in Citrus grandis var. Shatinyu
图2. 沙田柚β-D-木糖苷酶疏水性分析

Figure 3. Conserved domains of porcine β-D-Xylosidase
图3. β-D-木糖苷酶保守结构域
3.4. 跨膜预测
运用跨膜蛋白数据库TMbase (http://ch.embnet.org/software/TMPRED_form.html)预测β-D-木糖苷酶蛋白的跨膜区域。从图4可以看出该蛋白有4个跨膜区,跨膜区的氨基酸位置分别为:19~37、555~575、645~663和780~798。由此可以推测该蛋白为跨膜蛋白。
3.5. 蛋白质磷酸化预测
通过在线蛋白磷酸化位点分析软件NetPhos 2.0 Server,对β-D-木糖苷酶基因所编码的蛋白进行预测,结果表明该多肽链中分值在0.5以上的可能的磷酸化位点共有28个。其中,丝氨酸(Ser)可能的磷酸化位点共有10个,分别位于肽链的152、219、276、372、394、463、469、489、513和655位;苏氨酸(Thr)可能的磷酸化位点共有10个,分别位于肽链的71、113、117、127、187、299、319、330、504和688位;酪氨酸(Tyr)可能的磷酸化位点共有8个,分别位于肽链的33、202、350、351、392、606、674和697位。
3.6. 信号肽分析
利用SignaIP4.1软件对沙田柚β-D-木糖苷酶基因编码的氨基酸序列进行分析,其N端1-24个氨基酸(MARISNFILCFSICVSFLVISTNA)为信号肽序列(图5)。
3.7. 蛋白质二级结构及三级结构预测
通过在线分析软件Predict Protein (http://www.predictprotein.org/)对β-D-木糖苷酶蛋白二级结构进行预测,结果显示该蛋白含有α-螺旋为23.05%,β-折叠为13.35%,其他结构所占比例为63.60%。
利用SWISS-Model对沙田柚β-D-木糖苷酶蛋白三级结构进行预测,结果表明:β-D-木糖苷酶蛋白三级结构含有6个α-螺旋,4个β-折叠,其间由无规则卷曲连接(图6)。

Figure 4. Result of TMpred prediction on β-D-Xylosidase of Citrus grandis var. Shatinyu
图4. 沙田柚β-D-木糖苷酶基因编码蛋白的跨膜区预测

Figure 5. SignaIP analysis of β-D-Xylosidase protein from Citrus grandis var. Shatinyu
图5. 沙田柚β-D-木糖苷酶蛋白信号肽分析

Figure 6. Structure prediction of β-D-Xylosidase protein from Citrus grandis var. Shatinyu by SWISS-Model
图6. SWISS-Model模拟的沙田柚β-D-木糖苷酶蛋白的三级结构
3.8. 同源性分析
从GenBank数据库中下载其他植物β-D-木糖苷酶基因编码的氨基酸序列,通过序列同源性分析,沙田柚β-D-木糖苷酶基因编码的氨基酸与甜橙(C. sinensis, XM_006468131)和克莱门柚(C. clementina, XM_006449591) β-D-木糖苷酶的同源性分别为100%和99%。利用DNAman软件构建的系统树显示沙田柚β-D-木糖苷酶基因编码蛋白与芸香科的甜橙(C. sinensis, XM_006468131)和克莱门柚(C. clementina, XM_006449591)亲缘关系很近,属于同一个进化分支(图7)。
3.9. β-D-木糖苷酶基因在沙田柚自交和异交花柱中的表达
转录组测序结果分析表明该基因在自交花柱和异交花柱中的转录水平存在明显差异(图8)。在当天开花未授粉花柱中其表达量为0.07,在自交1 d花柱中迅速上升(43.13),第2 d下降(27.84),第3 d则迅速下降至1.95。而在异交1 d的花柱中,该基因的表达迅速上升(33.90),第2 d达到76.14,第3 d仍保持很高水平(49.63)。
利用RPKM (Reads Per Kb per Million reads) [17] 对该基因在自交和异交花柱中的表达水平估算,设定FDRS ≤ 0.001且差异倍数 ≥ 2倍的基因视作显著差异表达基因,对以RPKM值取2的对数值(Log2(RPKM))对异交1 d/自交1 d、异交2 d/自交2 d和异交3 d/自交3 d花柱中β-D-木糖苷酶基因的表达水平进行统计分析,其log2(RPKM ratio)分别为−0.35、1.45和4.67。
4. 讨论
木聚糖广泛分布于高等植物的细胞壁中,它与其他碳水化合物在花药和花粉发育过程中起着非常关键性的作用,它不仅为花药的发育提供营养,而且还作为信号物质影响花药和花粉的发育 [18] [19] 。Hruba等 [20] 对拟南芥不同发育阶段花粉中β-木糖苷酶基因的表达进行了分析,结果显示β-木糖苷酶与花粉萌发过程中花粉细胞壁的膨胀相关 [19] 。本文克隆的β-D-木糖苷酶基因沙田柚授粉,以及自交花柱和异交
 CL5107.Contig3_All (沙田柚,KU925841),Citrus sinensis (甜橙,XM_006468131),Citrus clementina (克莱门柚,XM_006449591),pyrifolia (梨,AB007121),Hordeum vulgare (大麦,AY029260),Acacia mangium (马占相思,AB839196),Arabidopsis thaliana (拟南芥,NM_125853),Nicotiana tabacum (烟草,JQ740833),Brassica napus (甘蓝型油菜,XM_013876205),Jatropha curcas (麻风树,XM_012237364),Cucumis sativus (黄瓜,XM_004136107),Sesamum indicum (芝麻,XM_011102494),Populus euphratica (胡杨,XM_011018060)
CL5107.Contig3_All (沙田柚,KU925841),Citrus sinensis (甜橙,XM_006468131),Citrus clementina (克莱门柚,XM_006449591),pyrifolia (梨,AB007121),Hordeum vulgare (大麦,AY029260),Acacia mangium (马占相思,AB839196),Arabidopsis thaliana (拟南芥,NM_125853),Nicotiana tabacum (烟草,JQ740833),Brassica napus (甘蓝型油菜,XM_013876205),Jatropha curcas (麻风树,XM_012237364),Cucumis sativus (黄瓜,XM_004136107),Sesamum indicum (芝麻,XM_011102494),Populus euphratica (胡杨,XM_011018060)
Figure 7.Phylogenetic tree based on amino acid sequences of β-D-Xylosidase
图7. 基于氨基酸序列的β-D-木糖苷酶系统发育树

Figure 8. The expression of β-D-Xylosidase gene
图8. β-D-木糖苷酶基因的表达
花柱中的表达存在较为显著的差异:未授粉花柱中该基因的表达量为(RPKM) 0.07,自花授粉1,2,3 d花柱中的表达量(RPKM)分别为43.13、27.84、1.95,在异花授粉1,2,3 d花柱中基因的表达量(RPKM)则分别为33.90、76.14和49.63。从上述结果可以看出无论自交授粉还是异交授粉,第1 d花柱中β-D-木糖苷酶基因的表达都表现为迅速升高,在自交授粉状态下,基因的表达第2 d开始下降,第3 d则下降到很低水平。而异交授粉过程中,该基因的表达则一直保持很高水平。
沙田柚β-D-木糖苷酶基因的这种表达模式与其参与分解细胞壁的功能相符。薛妙男等 [7] 观察到沙田柚自、异花授粉的第1 d,其花粉的萌发和花粉管的生长行为相同。花粉在柱头上经水合作用开始萌发,4~8 h花粉管通过柱头乳突细胞间隙进入柱头,16~24 h即可进入花柱道。随后,自交与异交授粉花粉管的生长出现明显差异,自花授粉的花粉管2~3 d时在花柱的1/2处生长受阻,而异交授粉花粉管则能正常生长,进入子房完成受精。β-D-木糖苷酶基因在授粉的第1 d高表达,参与花柱细胞壁的降解,有利于使花粉管进入花柱和生长。随后该基因的表达与花粉管在花柱中的生长密切相关,自花授粉2~3 d内β-D-木糖苷酶基因表达活性也急剧下降,与之对应的是花粉管生长受阻,不能完成受精。因此可以推断β-D-木糖苷酶基因可能参与了沙田柚授粉和自交不亲和性过程。但其机理有待进一步收入研究。
基金项目
国家自然科学基金(31360477);广西教育厅项目(2013YB036)。
文章引用
覃信梅,韩 愈,郭丹妮,刘玉洁,李惠敏,秦新民. 沙田柚β-D-木糖苷酶基因的鉴定及序列分析
Identification and Sequence Analysis of β-D-Xylosidase Gene from Citrus grandis var. Shatinyu Hort[J]. 林业世界, 2016, 05(04): 102-110. http://dx.doi.org/10.12677/WJF.2016.54012
参考文献 (References)
- 1. Wong, K.K., Tan, L.U. and Saddler, J.N. (1988) Multiplicity of Beta-1,4-Xylanase in Microorganisms: Functions and Application. Microbiological Reviews, 52, 305-317.
- 2. Sunna, A. and Antranikian, G. (1997) Xylanolytic Enzymes from Fungi and Bacteria. Critical Reviews in Biotechnology, 17, 39-67. http://dx.doi.org/10.3109/07388559709146606
- 3. Henrissat, B. and Bairoch, A. (1993) New Families in the Classification of Glycosyl Hydrolases Based on Amino Acid Sequence Similarities. Biochemical Journal, 293, 781-788. http://dx.doi.org/10.1042/bj2930781
- 4. 郑莉, 杨金玲, 朱平, 等. β-木糖苷酶的研究进展[J]. 浙江林业科技, 2005, 25(1): 59-64.
- 5. 范园园, 李秀婷, 腾超. 微生物β-木糖苷酶的研究进展[J]. 食品研究与开发, 2013, 34(12): 116-121.
- 6. Takayama, S. and Isogai, A. (2005) Self-Incompatibility in Plants. Annual Review of Plant Biology, 56, 467-489. http://dx.doi.org/10.1146/annurev.arplant.56.032604.144249
- 7. 薛妙男, 陈腾土, 杨继华. 沙田柚自交和异交亲和性观察[J]. 园艺学报, 1995, 22(2): 127-132.
- 8. 杨继华, 李红艳, 薛妙男. 沙田柚花柱S-糖蛋白分离及鉴定[J]. 广西师范大学学报, 2000, 18(4): 66-70.
- 9. 杨继华, 尧桂荣, 薛妙男. 沙田柚花柱S-糖蛋白的纯化和N-端序列测定[J]. 广西师范大学学报, 2001, 19(1): 72-79.
- 10. 秦新民, 李惠敏, 薛妙男, 等. 沙田柚自交,异交花粉管蛋白的双向电泳分析[J]. 广西植物, 2004, 24(6): 566-569.
- 11. 秦新民, 莫花浓, 万珊, 等. 沙田柚花粉管特异蛋白的免疫细胞化学研究[J]. 广西师范大学学报, 2008, 26(4): 113-115.
- 12. 秦新民, 莫花浓, 石菁萍, 等. 沙田柚花粉管S1-RNase免疫胶体金定位研究[J]. 广西农业科学, 2009, 40(5): 483- 485.
- 13. 薛妙男, 李义平, 张杏辉, 等. 沙田柚自交花柱中识别蛋白的免疫金定位[J]. 园艺学报, 2001, 28(1): 59-61.
- 14. Bariola, P.A., Howard, C.J., Taylor, C.B., et al. (1994) The Arabidopsis thaliana Ribonuclease Gene RNA1 Is Tightly Controlled in Response to Phosphate Limitation. The Plant Journal, 6, 673-685. http://dx.doi.org/10.1046/j.1365-313X.1994.6050673.x
- 15. 刘玉洁, 郭丹妮, 张渝, 等. 沙田柚RNase-like基因的克隆及序列分析[J]. 北方园艺, 2015(24): 70-74.
- 16. 杜玉杰. 构建分子系统树的简易方法[J]. 生物学通报, 2013, 48(4): 4-6.
- 17. Mortazavi, A., Williams, B.A., McCue, K., et al. (2008) Mapping and Quantifying Mammalian Transcriptomes by RNA-Seq. Nature Methods, 5, 621-628. http://dx.doi.org/10.1038/nmeth.1226
- 18. Clement, C. and Audran, J.C. (1999) In Anther and Pollen from Biology to Biotechnology. Springer Heidelberg, 69-90.
- 19. Clément, C., Chavant, L., Burrus, M., et al. (1994) Anther Starch Variations in Lilium during Pollen Development. Sexual Plant Reproduction, 7, 347-356. http://dx.doi.org/10.1007/BF00230513
- 20. Hruba, P., Honys, D., Twell, D., et al. (2005) Expression of β-Galactosidase and β-Xylosidase Genes during Microspore and Pollen Development. Planta, 220, 931-940. http://dx.doi.org/10.1007/s00425-004-1409-0
*通讯作者。