Material Sciences
Vol.07 No.02(2017), Article ID:20110,8
pages
10.12677/MS.2017.72026
Preparation and Biological Evaluation of Micro/Nanostructured CaTiO3/TiO2 Composites
Lu Yin, Jie Zhou, Lili Gao, Jie Weng, Bo Feng*
Key Laboratory of Advanced Technologies of Materials, School of Materials Science and Engineering, Southwest Jiaotong University, Chengdu Sichuan

Received: Received: Mar. 15th, 2017; accepted: Mar. 28th, 2017; published: Mar. 31st, 2017

ABSTRACT
Surface topography and chemical compositions play important roles in cell behaviors and tissue regeneration. In this work, titanium plates were etched with a mixture of calcium salt and acid to create a micro-porous surface, and then anodized to generate a TiO2 nanotube layer, finally hydrothermally treated in Ca(OH)2 solution for 1 - 4 h to obtain titanium-based micro/- nanostructured CaTiO3/TiO2 composites with different Ca2+ contents. Biological properties of the composites were evaluated by protein adsorption and osteoblast culture in vitro. The composites by hydrothermal treatment for 2 h show optimal properties to promote protein adsorption, osteoblast proliferation and differentiation. The micro/-nanostructured CaTiO3/TiO2 composite with a suitable content of calcium is a promising candidate of biomaterial for bone replacement.
Keywords:Titanium, Micro/-Nanostructured CaTiO3/TiO2, Hydrothermal Reaction, Protein Adsorption, Osteoblasts
微纳结构CaTiO3/TiO2复合材料的制备及生物学性能
尹露,周杰,高丽丽,翁杰,冯波*
西南交通大学材料先进技术教育部重点实验室,材料科学与工程学院,四川 成都

收稿日期:2017年3月15日;录用日期:2017年3月28日;发布日期:2017年3月31日

摘 要
植入物表面的形貌和成分是影响细胞行为和组织再生的重要因素。采用钙盐和酸的混合液使钛表面形成微孔,再经阳极氧化产生TiO2纳米管层,然后置于Ca(OH)2溶液中水热处理1~4 h,获得具有不同钙含量的钛基微纳结构CaTiO3/TiO2复合材料。通过蛋白吸附和体外成骨细胞培养评价其生物学性能。相对于1 h和4 h,水热反应时间为2 h的CaTiO3/TiO2复合材料具有最强的吸附蛋白能力、成骨细胞显示出最好的增殖行为和最高的成骨活性。具有适当钙含量的三维微纳结构钛CaTiO3/TiO2复合材在硬组织修复替换领域有着良好的应用前景。
关键词 :钛,微纳CaTiO3/TiO2,水热反应,蛋白吸附,成骨细胞

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
钛及其合金由于具有良好的生物相容性和力学性能而被广泛的用于骨科植入材料。但是钛及其合金具有生物惰性,钛在植入人体后无法与组织形成牢固的骨键合,会因为受力或摩擦发生松动,造成植入体失效 [1] [2] [3] 。为了提高钛的生物活性及其与骨组织之间的结合强度,研究者已提出多种表面改性方法,其中之一是表面粗糙多孔化 [4] [5] 。通过酸腐蚀或喷砂处理后形成的粗糙表面能有效地增强钛与骨组织之间的结合强度,改善其生物活性 [6] [7] [8] 。有研究表明,在钛表面氧化膜中引入Ca2+使其转化为活性氧化膜,有效的增强钛表面的生物学活性,而CaTiO3作为Ca2+存在的主要形式,具有潜在的生物活性和良好的化学稳定性 [9] [10] 。Sugiyama等 [11] 研究发现,CaTiO3能够促进成骨细胞粘附并通过Ca2+的第二信使作用促进成骨细胞增值。本工作以酸腐蚀形成的三维微米多孔Ti为基底,再经阳极氧化在多尺度微米孔的Ti表面形成TiO2纳米管阵列,再经水热反应将TiO2部分转化为CaTiO3,制备了具有多尺度微纳结构的CaTiO3/TiO2复合材料。对其结构和成分进行了分析表征,进一步通过蛋白吸附和成骨细胞培养对其生物学性质进行了评价,并对该材料体系生物活性增强的机理进行了探讨。
2. 实验部分
2.1. 材料和仪器
材料:钛(Ti)片:99.7%纯度(Aldrich);氢氟酸、硝酸、蒸馏水、氟化铵、丙酮、乙二醇、氢氧化钙、氯化钙和乙酸锌,试剂均为分析纯;胰蛋白酶(Sigma);胎牛血清(BI);a-MEM (Corning cellgro@, USA);磷酸盐缓冲液(PBS, Solarbio);戊二醛(天津科密欧);Triton X-100 (Solarbio);碱性磷酸酶(ALP)活性检测试剂盒(中生);Micro BCA蛋白检测试剂盒(Pierce)。
仪器:Philips X’Pert PRO型X-射线衍射仪分析(XRD);JSM-7001FJEOL场发射扫描电镜(FE-SEM);ESCALB MK-Ⅱ X射线光电子能谱分析(XPS);,JEM-2100F JEOL透射电子显微镜(TEM);μQuant Biotech酶标仪。
2.2. 三维微纳CaTiO3/TiO2异质结纳米管的制备
CaTiO3/TiO2异质结纳米管是以微孔Ti表面的TiO2纳米管为模板,在Ca(OH)2的溶液中水热处理制备而成。钛片用SiC砂纸抛光,紧接着依次用丙酮、乙醇和蒸馏水超声清洗,直至表面洁净,置于摩尔比为6:1的硝酸和氢氟酸的混合酸中酸洗,超声清洗后空气中干燥。将酸洗后的钛片置于放入HCl/CaCl2 (摩尔比7:1)体系中在60℃下腐蚀24 h,表面产生微孔,试样记为MPT。将MPT在乙二醇体系中(0.3 wt% NH4F + 95 vol% CH5OH + 5 vol% H2O)恒压40 V条件下阳极氧化2 h,制备TiO2纳米管,试样记为MNT。将纯钛直接进行阳极氧化作为对照组,记为TNT。然后制备的MNT试样置于盛有饱和Ca(OH)2溶液的高压反应釜中进行水热反应,制备三维微纳CaTiO3/TiO2复合材料,水热结束后,超声清洗并干燥。最后,对所有试样进行450℃热处理3 h。对应不同的水热时间1 h、2 h和4 h,试样分别记为MNCT (1 h)、MNCT (2 h)和MNCT (4 h)。通过XRD和TEM分析试样表面成分和晶相,SEM观察表面形貌。
2.3. 蛋白吸附实验
蛋白质吸附试验在细胞培养基(10%胎牛血清的α-MEM)中进行。每组3个平行试样和空白对照组,在紫外照射灭菌处理后分别置于24孔板中,每个孔分别加入1 mL的细胞培养基,置于37℃、5%的CO2细胞培养箱中培养2 h。整个培养过程在无菌条件下操作。培养结束后,收集试样吸附蛋白后的培养液于新的孔板,采用BCA试剂盒测定其中蛋白浓度。并且通过XPS分析蛋白吸附后试样的表面成分。
2.4. 成骨细胞培养和评价
从小鼠颅盖中获得原代成骨细胞,所用的培养基与蛋白吸附实验的培养基相同,同样培养于37℃、5%的CO2细胞培养箱中。每2天换液,3到4天传代。样品经紫外灭菌后置于24孔板中,将第五代成骨细胞以2 × 104/孔接种到样品上。培养3天和7天后使用Alamer Blue方法检测细胞增殖情况。其过程是先配置无酚红培养基(M199:Alamar Blue:FBS体积比8:1:1),移除原培养基以后,每孔加入0.5 mL/well无酚红培养基置于培养箱中孵育2~4小时,孵育结束后,每个孔取200 μL培养基于96孔板中,用酶标仪在590 nm波长下测量吸光度值。在细胞培养3天和7天后,用2.5%戊二醛固定细胞,然后用梯度乙醇脱水、冷冻干燥和喷金后用SEM观察细胞形态。培养14天以后,用碱性磷酸酶试剂盒 (ALP)测试ALP活性。检测时先将样品转入新的24孔板,每孔加入细胞裂解液1 mL,反复冻融吹打3次裂解细胞。在520 nm的波长下用酶标仪测定吸光度,判断ALP活性。
3. 结果和讨论
3.1. 三维微纳CaTiO3/TiO2纳米管的表征
从图1(a)可以发现TNT阵列管径约为100 nm,管长约为4 mm。MPT表面(b)有10~20 mm大小不一的微孔,且出现大孔嵌小孔的复杂三维结构。阳极氧化后MNT(c)试样表面微孔形貌依然清晰可见,并以微孔为基底生成的纳米管均匀排列,形成了多级尺寸的微纳米结构,试样的比表面积和表面能增加。图2(d)~(f)为多尺度的微纳CaTiO3/TiO2复合材料的SEM图。在MNCT (1 h)的标的纳米管顶端有少量的立方体颗粒物沉积,通过之后的XRD分析(图2(a))得知此颗粒沉积物CaTiO3晶体;MNCT (2 h) (图2(e))可以发现CaTiO3晶体颗粒基本覆盖了微孔表面,观察不到纳米管,随着水热时间的延长,MNCT (4 h) (图2(f))微孔表面与MNCT (2 h)一样被CaTiO3颗粒覆盖而不见纳米管,并且CaTiO3纳米晶体颗粒明显增多,并且晶粒也因继续膨胀而变大。

Figure 1. SEM micrographs of (a): TNT; (b): MPT; (c): MNT; (d): MNCT (1 h); (e): MNCT (2 h) and (f) MNCT (4 h)
图1. 各试样的SEM图(a):TNT;(b):MPT;(c):MNT;(d):MNCT (1 h);(e):MNCT (2 h)和(f):MNCT (4 h)

Figure 2. (a) XRD patters of MNCT (1 h), MNCT (2 h) and MNCT (4 h), (b) TEM micrographs and (c) high resolution of MNCT (2 h)
图2. (a) MNCT (1 h),MNCT (2 h)和MNCT (4 h)的XRD图和MNCT (2 h)的TEM (b)和高分辨图(c)
图2(a)为MNCT (1 h),MNCT (2 h)和MNCT (4 h)的XRD图谱。三种试样都出现了Ti、锐钛矿TiO2以及CaTiO3的衍射峰。随水热时间延长,锐钛矿TiO2的峰变弱而CaTiO3峰变强,因为经过水热处理TiO2逐渐的转变生成了CaTiO3削弱了锐钛矿的峰。图2(b)为MNCT (2 h)的TEM图,可以清晰地发现破裂的纳米管,晶体颗粒分布在管内外并且部分聚集。因为在水热反应中TiO2转变为CaTiO3,TiO2纳米管因为结晶膨胀被破坏,这也是在SEM图中观察不到纳米管的原因。由HRTEM (图2(c))测得晶粒的晶面间距0.265 nm和0.351 nm,分别对应CaTiO3(112)晶面和锐钛矿TiO2(101)晶面。说明微纳CaTiO3/TiO2复合材料通过酸腐蚀、阳极氧化水热法已经成功制备。
上述测试结果表明,TiO2在Ca(OH)2溶液中通过水热反应形成CaTiO3晶粒,但是在TiO2转化成为CaTiO3的过程中,由于晶格参数不匹配,CaTiO3晶粒膨胀造成TiO2纳米管破坏,破坏的程度随着水热时间而增加,直到原位TiO2完全转变成CaTiO3层而失去纳米管结构。TiO2完全转变成CaTiO3层遵循“奥斯瓦尔德熟化”机制,其“溶解–沉淀”的过程如下 [12] :


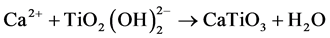
三维微纳CaTiO3/TiO2复合材料中CaTiO3和TiO2的比例,也即钙含量可以通过水热时间来调控,并改变其表面形貌和表面化学,从而影响生物学性能。
3.2. 蛋白吸附分析
图3(A)为各试样蛋白吸附2 h后的蛋白吸附量百分比。MNT试样表面比TNTs和MPT表面吸附更多的蛋白质。这是因为微纳结构的表面比单纯的纳米结构和微孔结构具有更大的比表面积,并且含有更丰富的锐钛矿晶体,增加了蛋白吸附的活性位点。水热反应后,含CaTiO3的材料表面蛋白吸附能力比MNT 更强,由此可以推测Ca的存在能促进蛋白吸附。MNCT (1 h)纳米管保持较好,但CaTiO3含量太低。而MNCT (4 h)表面虽然CaTiO3含量较大,但CaTiO3晶粒的膨胀转化破坏了纳米管结构,减小了比表面积。MNCT (2 h)既具有较大的比表面积,又有适量CaTiO3,所以MNCT (2 h)具有最高的蛋白吸附量。
图3(B) MNT及MNCT蛋白吸附后的XPS图。通过全谱可以发现MNCT (2 h)表面不仅出现了Ca、Ti、O和C的峰,还出现了N的峰(图3(B) a),说明蛋白吸附到材料表面 [13] [14] 。据相关研究报道 [15] ,CaTiO3中Ca 2p3/2的结合能为347.0 eV,Ca 2p1/2的结合能为350.5 eV,从图3(B) b发现经过蛋白吸附后Ca 2p的结合能分别向低结合能方向偏离了0.6 eV和0.7 eV,变为346.4 eV和349.8 eV。这表明蛋白吸附后改变了Ca的化学状态,可以推测出Ca对蛋白具有亲和性,并发生了化学反应。图3(B) c和d分别为MNT和MNCT (2 h)的N 1s高分辨率谱,c图显示MNT仅在结合能399.8 eV处有峰,此峰为蛋白质中氨基的峰。而MNCT (2 h)的N 1s除了399.8 eV以外,在396.4 eV还出现了一个亚峰,由此说明MNCT (2 h)表面的蛋白存在另外一种化学态。蛋白吸附的过程极其复杂,仅此难以判断结合能为396.4 eV来自于N的何种化学态,可能与CaTiO3表面吸附的蛋白构型和含氮基团的价键变化相关。通过以上分析得知蛋白质在三维微纳CaTiO3/TiO2表面表现出化学吸附特性。
3.3. 成骨细胞评价
图4(a)为3天和7天时细胞在各试样表面的增殖情况,(b)为14天细胞在各试样表面的ALP活性测试结果。在不同的时间点,试样表面细胞增殖情况呈现MNCT (2 h) > MNCT (1 h) ≈ MNCT (4 h) > MNT > TNTs > MPT的变化规律。ALP呈现MNCT (2 h) > MNT ≈ MNCT (1 h) > MNCT (4 h) > TNTs > MPT的变化规律,提示MNCT (2 h)最有利于成骨细胞增殖和成骨分化。
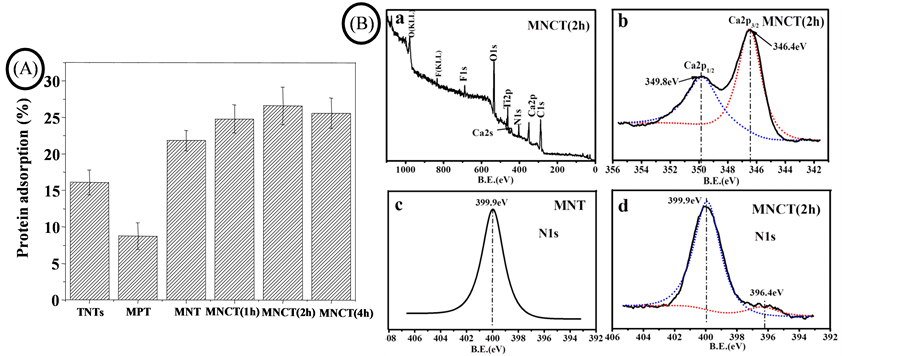
Figure 3. (A) Percentage of protein adsorbed to samples and (B) XPS spectra of MNT and MNCT after protein adsorption. (a): Full spectra of MNCT (2 h). (b): High resolution spectra of MNCT Ca 2p. (c and d): High resolution spectra of MNT and MNCT (2 h) N 1s
图3. (A) 各样蛋白吸附量百分比和(B) MNT及MNCT蛋白吸附后的XPS图((a):MNCT (2 h)全谱,(b):MNCT Ca 2p高分辨谱,(c和d):MNT和MNCT (2 h) N 1s高分辨谱)

Figure 4. (a) Osteoclast proliferation at 3 and 7 days and (b) ALP expression in cells grown on each sample at 14 days
图4. (a) 3天和7天细胞增殖情况和(b) 14天细胞的ALP活性

Figure 5. SEM micrographs of osteoblasts after 3 and 7 d of culture on (a) TNT, MPT and MN as well as (b) MNCT (1 h), MNCT (2 h) and MNCT (4 h)
图5. (a) TN,MPT和MN以及(b) MNCT (1 h),MNCT (2 h)和MNCT (4 h)上成骨细胞培养3天和7天的SEM图
图5(a)和图5(b)为各试样表面成骨细胞培养3天和7天的SEM图。从(a)中可以观察到无论是在3天或是7天,与MPT和TNT表面的细胞相比,MNT表面的成骨细胞有更多的伪足伸展,细胞铺展成星状,并且细胞形态良好,丝状伪足沿着孔内壁或是沿着孔的边缘伸展。这是因为MNT的微纳表面能够提供三维构型和更大的比表面积,可以有效促进细胞的粘附和增值,具有较好的生物活性。MNCT(1h)试样表面的细胞形貌(b)与MNT (a)的细胞形态相似。MNCT (4 h)细胞虽有伪足伸展,但细胞形态和铺展仍较差。MNCT (2 h)试样表面细胞呈多伪足交叉的现象,并且细胞与细胞沿孔相互桥联,显示出最好的铺展与生长行为。
水热反应后,材料表面被CaTiO3所覆盖。由于有大量的Ca2+成为表面正电荷活性位,成骨细胞外基质中某些配体蛋白例如纤维连接蛋白(FN)和玻连蛋白(VN)趋向于正电性的材料表面 [16] ,与钛表面发生作用,形成强的结合,促进成骨细胞在表面粘附以及增值。另外,除了材料的表面成分,影响细胞粘附和增值的因素还有材料的表面形貌。随着水热时间的增加,TiO2转变为CaTiO3,而CaTiO3晶粒的膨胀会造成纳米管逐渐被破坏,材料的比表面积减小,表面能降低,蛋白吸附量相应减少。因此,钛表面具有适宜的微纳多孔结构和适量CaTiO3成分,如MNCT (2 h),能有效地促进细胞黏附、增殖与生长,展现出优异的生物学性能。
4. 结论
以酸腐蚀形成的三维微米多孔Ti为基底,首先通过阳极氧化在其表面形成TiO2纳米管阵列,再经水热反应将TiO2部分转化为CaTiO3,制备了具有三维微纳结构的CaTiO3/TiO2复合材料。水热反应时间为2 h的MNCT (2 h)样品在蛋白吸附及成骨细胞培养实验中表现出相对更好的生物活性。其原因在于三维微纳多孔结构能够能为蛋白吸附和细胞接触提供更多的活性位点;表面Ca离子对蛋白和细胞具有良好的亲和性。钛表面微纳结构化结合适量CaTiO3成分能有效改进钛的生物学性能。
致谢
这项工作是由国家自然科学基金(31570955)和中国四川省应用基础研究计划(2015JY0036)支持。
文章引用
尹 露,周 杰,高丽丽,翁 杰,冯 波. 微纳结构CaTiO3/TiO2复合材料的制备及生物学性能
Preparation and Biological Evaluation of Micro/Nanostructured CaTiO3/TiO2 Composites[J]. 材料科学, 2017, 07(02): 204-211. http://dx.doi.org/10.12677/MS.2017.72026
参考文献 (References)
- 1. Geetha, M., et al. (2009) Ti Based Biomaterials, the Ultimate Choice for Orthopaedic Implants—A review. Progress in Materials Science, 54, 397-425. https://doi.org/10.1016/j.pmatsci.2008.06.004
- 2. Lalor, P.A., et al. (1991) Sensitivity to Titanium. A Cause of Implant Failure. Journal of Bone & Joint Surgery British Volume, 73, 25-28.
- 3. Olmedo, D., et al. (2003) Macrophages Related to Dental Implant Failure. Implant Dent, 12, 75-80. https://doi.org/10.1097/01.ID.0000041425.36813.A9
- 4. Zheng, X., et al. (2000) Bond Strength of Plasma-sprayed Hydroxyapatite/Ti Composite Coatings. Biomaterials, 21, 841-849. https://doi.org/10.1016/S0142-9612(99)00255-0
- 5. Zhang, P., et al. (2013) Effect of Ti-OH Groups on Microstructure and Bioactivity of TiO2 Coating Prepared by Micro-Arc Oxidation. Applied Surface Science, 268, 381-386. https://doi.org/10.1016/j.apsusc.2012.12.105
- 6. Brammer, K.S., et al. (2009) Improved Bone-Forming Functionality on Diameter-Controlled TiO2 Nanotube Surface. Acta Biomater, 5, 3215-3223. https://doi.org/10.1016/j.actbio.2009.05.008
- 7. Xia, L., et al. (2012) In Vitro and in Vivo Studies of Surface-structured Implants for Bone Formation. International Journal of Nanomedicine, 7, 4873-4881. https://doi.org/10.2147/IJN.S29496
- 8. Le, G.L., et al. (2007) Surface Treatments of Titanium Dental Implants for Rapid Osseointegration. Dental Materials, 23, 844-854. https://doi.org/10.1016/j.dental.2006.06.025
- 9. Ohtsu, N., et al. (2007) CaTiO3 Coating on Titanium for Biomaterial Application: Optimum Thickness and Tissue Response. Journal of Biomedical Materials Research Part A, 82, 304-315. https://doi.org/10.1002/jbm.a.31136
- 10. Wu, S., et al. (2015) Evaluation of the Biocompatibility of a Hydroxyapatite-CaTiO3 Coating in Vivo. Biocybernetics & Biomedical Engineering, 35, 296-303. https://doi.org/10.1016/j.bbe.2015.05.001
- 11. Sugiyama, N., et al. (2009) Bioactive Titanate Nanomesh Layer on The Ti-Based Bulk Metallic Glass by Hydrothermal-Electrochemical Technique. Acta Biomater, 5, 1367-1373. https://doi.org/10.1016/j.actbio.2008.10.014
- 12. Chen, C.Y., et al. (2012) CaTiO3 Nanobricks Prepared From Anodized TiO2 Nanotubes. Electrochemistry Communications, 22, 101-104. https://doi.org/10.1016/j.elecom.2012.05.012
- 13. Serro, A.P., Fernandes, A.C., Saramago, B., Lima, J. and Barbosa, M.A. (1997) Apatite Deposition on Titanium Surfaces. The Role of Albumin Adsorption. Biomaterials, 18, 963-963. https://doi.org/10.1016/S0142-9612(97)00031-8
- 14. Serro, A.P., Fernandes, A.C. and Jesus Vieira Saramago, B. (1997) Calcium Phosphate Deposition on Titanium Surfaces in the Presence of Fibronectin. Journal of Biomedical Materials Research Part A, 49, 345-352. https://doi.org/10.1002/(SICI)1097-4636(20000305)49:3<345::AID-JBM7>3.0.CO;2-R
- 15. Wei, D., Zhou, Y., Jia, D. and Wang, Y. (2008) Formation of CaTiO3/TiO2 Composite Coating on Titanium Alloy for Biomedical Applications. Journal of Biomedical Materials Research Part B Applied Biomaterials, 84, 444-451. https://doi.org/10.1002/jbm.b.30890
- 16. Anselme, K. (2000) Osteoblast Adhesion on Biomaterials. Biomaterials, 21,667-681. https://doi.org/10.1016/S0142-9612(99)00242-2
*通讯作者。