Advances in Clinical Medicine
Vol.07 No.02(2017), Article ID:21009,7
pages
10.12677/ACM.2017.72014
Molecular Mechanism of Liriope Muscari Baily Saponins C Induced Cellular Autophagy of SGC7901
Chengzheng Han1*, Guozheng Xing2, Shaofeng Liu3, Mengying Zhang4, Min Zhong4, Zhen Han3, Jiaying Guo3
1Clinic of Integrated Traditional Chinese and Western Medicine, The First Affiliated Hospital of Wannan Medical College, Wuhu Anhui
2School of Management Science and Engineering, Anhui University of Technology, Ma’anshan Anhui
3Department of Gastroenterology, The First Affiliated Hospital of Wannan Medical College, Wuhu Anhui
4Department of Central Laboratory, The First Affiliated Hospital of Wannan Medical College, Wuhu Anhui
*通讯作者。

Received: May 19th, 2017; accepted: Jun. 16th, 2017; published: Jun. 19th, 2017

ABSTRACT
This study is to investigate the antitumor activity of Liriope muscari baily saponins C. MTT, flow cytometric analysis and western blotting were to used to detect the proliferation activity, apoptosis and autophagy of SGC 7901. The results showed that Liriope muscari baily saponins C can inhibit cell proliferation, but it can induce autophagy, not apoptosis. Western blotting results showed that Liriope muscari baily saponins C can induce autophagy marker protein expression of Beclin-1 and make LC3-A become LC3-B. Therefore, this process is irrelevant to the apoptosis for inhibiting the proliferation of SGC7901, but it may induce autophagy by inhibiting the classical signal pathway of Akt/mTOR.
Keywords:Liriope Muscari Baily Saponins C, The Effect of Antitumor, Autophagy, Apoptosis
短葶山麦冬皂苷C诱导人胃癌细胞SGC7901自噬机制初探
韩诚正1*,邢国正2,刘少峰3,张梦莹4,钟民4,韩真3,郭家英3
1中西医结合门诊,皖南医学院弋矶山医院,安徽 芜湖
2管理科学与工程学院,安徽工业大学,安徽 马鞍山
3消化内科,皖南医学院弋矶山医院,安徽 芜湖
4中心实验室,皖南医学院弋矶山医院,安徽 芜湖

收稿日期:2017年5月19日;录用日期:2017年6月16日;发布日期:2017年6月19日

摘 要
以人胃癌细胞SGC7901为研究对象,探讨短葶山麦冬皂苷C的抗肿瘤作用及其分子机制。采用MTT检测、流式细胞仪分析、免疫蛋白印记实验,分别检测胃癌细胞SGC7901的增殖、凋亡及自噬。结果表明,短葶山麦冬皂苷C可抑制细胞增殖,但并不诱导细胞凋亡,可诱导细胞自噬,Western blotting检测结果表明短葶山麦冬皂苷C可引起自噬标志性蛋白Beclin-1表达增加及LC3-A转变为LC3-B。因此,短葶山麦冬皂苷C抑制胃癌细胞SGC7901增殖可能与凋亡无关,而是通过抑制经典的自噬信号转导通路Akt/mTOR诱导其发生自噬,从而发挥抗肿瘤作用。
关键词 :短葶山麦冬皂苷C,抗肿瘤作用,自噬,细胞凋亡

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
胃癌是消化系统的常见肿瘤之一。目前认为胃癌的发生、发展是一个多阶段、多步骤、有序的过程。各种外因导致的胃黏膜炎症进而引起一些基因水平的变化已被大量研究证实,涉及多种复杂的细胞内的级联反应。而在其化疗的过程中,常常由于各种原因引起化疗失败。而肿瘤细胞凋亡失调是引起化疗失败的主要原因之一,因此,通过其他途径阐明胃癌细胞增殖与死亡的机制,以及开发通过其他方式抑制肿瘤的药物具有重要的理论和实践意义。
自噬是继坏死和凋亡后发现的第3种细胞死亡形式,对肿瘤细胞具有双重作用 [1] :自噬可以清除肿瘤细胞内折叠异常的蛋白和功能异常的细胞器,防止基因损伤从而抑制肿瘤的发生。相反,肿瘤细胞可利用自噬作用使自身在营养缺乏和低氧的状况下得以存活。
目前抗肿瘤药物正从传统的细胞毒类药物向针对肿瘤某一或多个靶点的新型药物发展。因此,寻找靶向于自噬分子的抗肿瘤药物对于肿瘤的治疗具有重要的意义 [2] 。许多中药及其活性成分可诱导肿瘤细胞发生自噬,例如苦参碱可以诱导肝癌细胞HepG2形成自噬小体 [3] ,而白藜芦醇可以诱导卵巢癌细胞发生自噬等。麦冬作为中草药中养阴药的一种,具有养阴生津,润肺清心之功效。麦冬块根中富含多糖、皂苷、黄酮等有效成分,具有强心、利尿、抗菌等药理作用 [4] 。由于汉代经方麦门冬汤经现代研究发现,对晚期肿瘤具有很好的疗效,作为君药的麦冬其抗肿瘤作用逐渐得到重视,研究表明麦冬多糖可抑制S180肉瘤和腹水瘤的生长,对小鼠原发性肝癌也有一定的抑制作用 [5] 。前期作者通过对麦冬各成分的筛选,发现短葶山麦冬皂苷C (图1)具有较强的抗肿瘤作用,本文初探其诱导人胃癌细胞SGC7901发生自噬的作用及分子机制,以期为其临床应用奠定理论基础和实验依据。
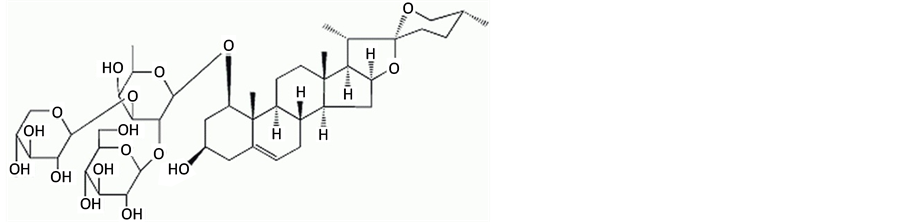
Figure 1. The chemical structure of Liriope muscari baily saponins C
图1. 短葶山麦冬皂苷C化学结构式
2. 材料与方法
2.1. 实验材料
0.25% Tripsin-EDTA、RPMI-1640、胎牛血清(美国GIBCO)、MTT (美国Amresco)、DMSO (溶解Formazan结晶) (中国上海久亿化学试剂有限公司20120322);3-MA、短葶山麦冬皂苷C (Sigma公司);Annexin V-FITC凋亡检测试剂盒(碧云天试剂公司);Akt、p-Akt、Beclin-1及LC3等一抗及相应二抗(Cell Signaling Technology公司)。
2.2. 细胞培养
胃癌细胞SGC7901由皖南医学院弋矶山医院中心实验室馈赠,用含10%胎牛血清的RPMI1640培养基(含L-精氨酸、L-门冬酰胺及L-门冬氨酸等成分)培养。取对数生长期细胞用于实验。
2.3. MTT检测
取对数生长期细胞,以细胞数5 × 10%/ml接种于96孔培养板。培养12 h后,加入不同浓度的短葶山麦冬皂苷C。24 h后每孔加入5 g/l MTT溶液10 μl,继续培养4 h,每空加入二甲基亚砜100 μl,37℃振荡30 min,用酶标仪在570 nm波长处测定其OD值,按公式计算细胞抑制率:细胞抑制率 = (1 − 实验组OD值/对照组OD值) × 100%。对于自噬依赖性实验,则在加入短葶山麦冬皂苷C前2 h预孵育自噬抑制剂3-MA (5 mmol/l),以下均同。
2.4. 流式细胞仪分析
收集经短葶山麦冬皂苷C作用24 h的胃癌细胞SGC7901,按照Annexin V-FITC 凋亡检测试剂盒说明书操作后用流式细胞仪(BD FACSCalibur, USA)分析细胞凋亡率。
2.5. Western Blotting检测
收集经短葶山麦冬皂苷C作用24 h的胃癌细胞SGC7901,PBS洗2次(1000 r∙min−1, 5 min)后,分别应用细胞裂解液试剂盒裂解细胞。蛋白定量后分别取50 μg的蛋白加入上样缓冲液,95℃变性10 min。8%聚丙烯酰胺-SDS凝胶电泳后,电转移至硝酸纤维膜上,5%脱脂奶粉封闭后依次加入相应的一抗和二抗,室温孵育2 h,TBST缓冲液洗涤5次,每次10 min。加入化学发光试剂后放入暗盒中压片并依次显影、定影及摄像。
2.6. 统计学分析
所有数据均用X ± S表示,组建比较应用SPSS 13.0统计包进行单因素方差分析。
3. 结果
3.1. 短葶山麦冬皂苷C对胃癌细胞SGC7901生长的影响
胃癌细胞SGC7901经不同浓度的短葶山麦冬皂苷C作用24 h后,细胞增殖均受到同程度地抑制,并呈剂量依赖性,IC50为6 mg/ml (图2、表1)。应用自噬抑制剂3-MA预孵育细胞后,可以镜下发现短葶山麦冬皂苷C抗SGC7901细胞增殖作用减轻,甚至逆转,提示该作用是自噬依赖性。
3.2. 短葶山麦冬皂苷C对胃癌细胞SGC7901凋亡的影响
Annexin V-FITC检测结果表明:经不同浓度的短葶山麦冬皂苷C处理24 h后,胃癌细胞SGC7901的凋亡率与组间相比无显著性差异,5 mg/ml,10 mg/ml,20 mg/ml 短葶山麦冬皂苷C作用24 h后的细胞凋亡率分别是(36.0 ± 0.20)%,(35.2 ± 0.13)%,(23.7 ± 0.10)%,(F = 0.713, P = 0.571),提示在该实验剂量下短葶山麦冬皂苷C并不诱导胃癌细胞SGC7901发生凋亡(图3)。
3.3. 短葶山麦冬皂苷C通过Akt/mTOR信号通路诱导胃癌细胞SGC7901发生自噬
经图像处理系统分析得出Beclin-1、LC3和β-Actin的灰度值,以β-Actin灰度值为参照,Western blotting结果表明,与对照组相比10 mg/ml的短葶山麦冬皂苷C作用胃癌细胞SGC7901后,自噬相关蛋白Beclin-1的表达发生了明显变化(P < 0.05);而LC3-B的表达并不明显,提示LC3-A可能没有脂化成LC3-B,但当自噬抑制剂3-MA阻断了PI3K/AKT/Beclin-1通路后,可以逆转上述的情况,(P < 0.05),同时LC3-B的表达增强,提示SGC7901通过LC3-B发生自噬,Beclin-1和LC3-B的表达均能受到短葶山麦冬皂苷C的影响,且可被自噬抑制剂3-MA逆转,可能短葶山麦冬皂苷C可以通过经典的两条自噬相关信号通路诱导了SGC7901发生了自噬,从而抑制细胞增殖(图4)。
Table 1. Liriope muscari baily saponins C inhibits cell growth of SGC7901
表1. MTT法测定Lmbs C对SGC7901的增殖影响
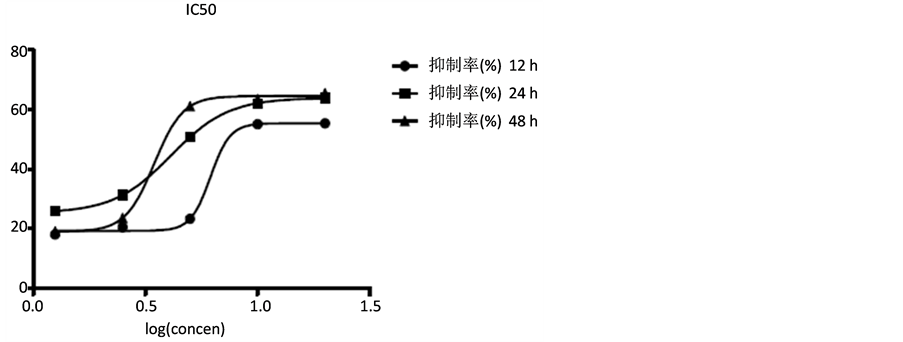
Figure 2. Liriope muscari baily saponins C inhibits cell growth of SGC7901
图2. MTT法测定Lmbs C对SGC7901的增殖影响
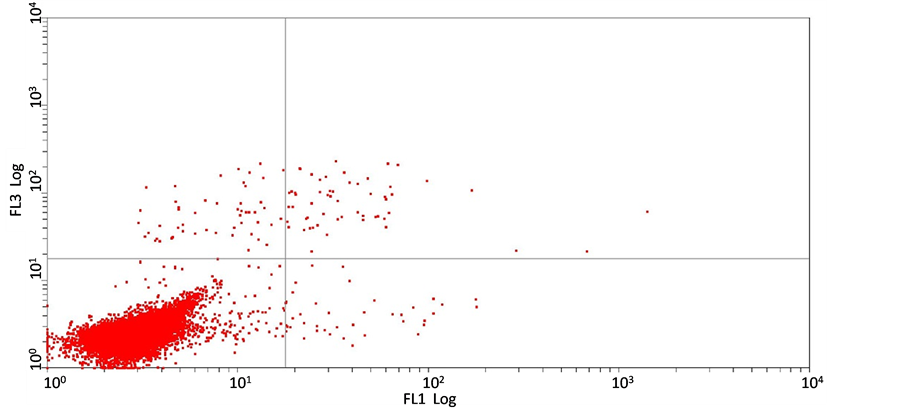 (a)
(a)
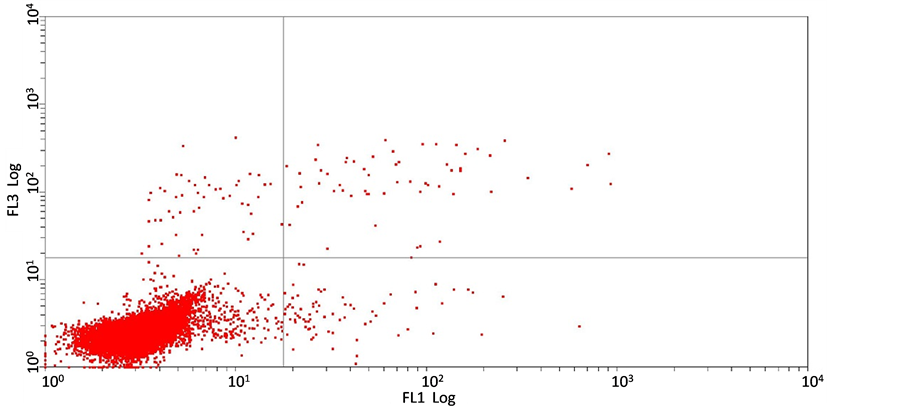 (b)
(b)
 (c)
(c) (d)(a) 空白对照组;(b) 5 mg/ml Lmbs C;(c) 10 mg/ml Lmbs C;(d) 20 mg/ml Lmbs C。图3为Lmbs C作用24 h后SGC7901的凋亡率。
(d)(a) 空白对照组;(b) 5 mg/ml Lmbs C;(c) 10 mg/ml Lmbs C;(d) 20 mg/ml Lmbs C。图3为Lmbs C作用24 h后SGC7901的凋亡率。
Figure 3. Liriope muscari baily saponins C induces cell apoptosis of SGC7901
图3. Annexin V-FITC/PI双染流式细胞术测定Lmbs C对SGC7901的凋亡率的影响
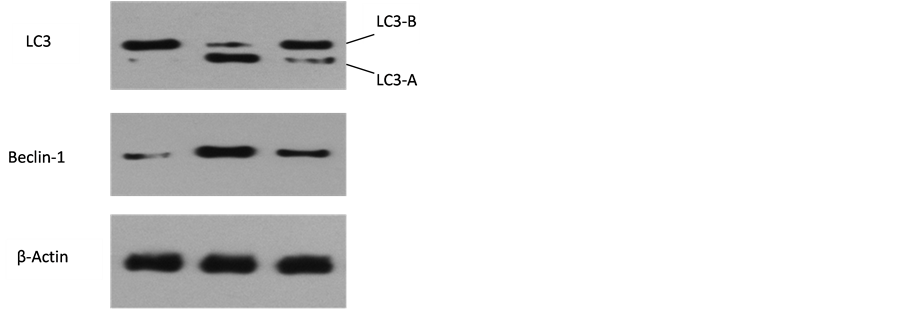
Figure 4. Liriope muscari baily saponins C induces LC3 and Beclin-1 protein expression of SGC7901
图4. 10 mg/ml Lmbs C作用于SGC7901后Western blotting 法测定beclin-1、LC3-A和LC3-B
4. 讨论
自噬与细胞死亡之间的因果关系还没有最后的定论,随着不断的研究,有人提出自噬性细胞死亡的概念。越来越多的研究发现中草药及其活性成分可诱导肿瘤细胞发生自噬,抑制细胞增殖,如表没食子儿茶精 [6] 。本研究表明,短葶山麦冬皂苷C产生的抑制胃癌细胞SGC7901增殖作用可能与凋亡无关,但自噬抑制剂3-MA可以影响自噬相关蛋白的表达,逆转其抗增殖作用,提示其抗增殖作用可能是通过自噬产生的,而且是自噬依赖性的。
自噬氛围大自噬、小自噬和分子伴侣介导的自噬,PI3K/Akt/mTOR信号通路是细胞发生自噬最主要的机制之一 [7] ,对双侧分离膜/自噬体(IM/AP)的形成有重要的作用,其下游的Beclin-1和LC3蛋白则是形成AP的两条中药途径。为了进一步阐明短葶山麦冬皂苷C诱导胃癌细胞SGC7901发生自噬的分子机制,对Akt/mTOR信号通路中一些关键蛋白进行了研究。实验结果表明,短葶山麦冬皂苷C剂量可能通过抑制Akt及其下游靶蛋白mTOR磷酸化,并上调该信号通路Beclin-1的表达,提示短葶山麦冬皂苷C仅抑制Akt/mTOR信号通路关键蛋白的活化。自噬抑制剂3-MA抑制短葶山麦冬皂苷C诱导的自噬后并不引起细胞增殖恢复,虽然Beclin-1的表达减少,但和LC3-A脂化为LC3-B的程度提高,提示短葶山麦冬皂苷C诱导的胃癌细胞SGC7901自噬可能是其产生抗肿瘤作用的主要原因。近年来的研究表明,Akt/mTOR信号通路是抗肿瘤药物研发的一个潜在靶点,而短葶山麦冬皂苷C通过抑制Akt/mTOR信号通路产生自噬依赖性的抗胃癌细胞SGC7901作用,这提供了短葶山麦冬皂苷C抗肿瘤作用的分子机制,也为其进一步研究及应用于临床提供了实验依据和理论基础。
基金项目
皖南医学院中青年基金自然科学研究项目,(项目编号:WK
安徽省高等学校自然科学研究项目,(项目编号:KJ
文章引用
韩诚正,邢国正,刘少峰,张梦莹,钟 民,韩 真,郭家英. 短葶山麦冬皂苷C诱导人胃癌细胞SGC7901自噬机制初探
Molecular Mechanism of Liriope Muscari Baily Saponins C Induced Cellular Autophagy of SGC7901[J]. 临床医学进展, 2017, 07(02): 84-90. http://dx.doi.org/10.12677/ACM.2017.72014
参考文献 (References)
- 1. Lieberman, A.P., Puertollano, R., Raben, N., Slaugenhaupt, S., Walkley, S.U. and Ballabio, A. (2012) Autophagy in Lysosomal Storage Disorders. Autophagy, 8, 719-730. https://doi.org/10.4161/auto.19469
- 2. Jiang, P. and, Mi-zushima, N. (2014) Autophagy and Human Diseases. Cell Research, 24, 69-79. https://doi.org/10.1038/cr.2013.161
- 3. Zhang, J.Q., Li, Y.M., Liu, T., et al. (2010) Antitumor Effect of Matrine in Human Hepatoma G2 Cells by Inducing Apoptosis and Autophagy. World Journal of Gastroenterology, 16, 4281-4290. https://doi.org/10.3748/wjg.v16.i34.4281
- 4. 余伯阳, 殷霞, 荣祖元, 杨体模, 张春红, 徐国钧. 短葶山麦冬皂甙C的药理活性研究[J]. 中国药科大学学报, 1994, 25(5): 286-288.
- 5. 舒琦瑾. 新加沙参麦冬汤抗肿瘤的实验研究[J]. 中国中医基础医学杂志, 2002, 8(4): 34-36.
- 6. Zhang, Y., Yang, N.D., Zhou, F., et al. (2012) (-)-Epigallocatechin-3-Gallate Induces Non-Apoptotic Cell Death in Human Cancer Cells via ROS-Mediated Lysosomal Membrane Permeabilization. PLOS One, 7, e46749. https://doi.org/10.1371/journal.pone.0046749
- 7. Zou, C.Y., Smith, K.D., Zhu, Q.S., et al. (2009) Dual Targeting of AKT and Mammalian Target of Rapamycin: A Potential Therapeutic Approach for Malignant Peripheral Nerve Sheath Tumor. Molecular Cancer Therapeutics, 8, 1157-1168. https://doi.org/10.1158/1535-7163.MCT-08-1008
