Advances in Clinical Medicine
Vol.07 No.03(2017), Article ID:21662,7
pages
10.12677/ACM.2017.73030
Combined Detection of MDR1 and BAALC Gene Expression in Intermediate Risk Group Acute Myeloid Leukemia Patients and Their Clinical Implication
Pengcheng Shi, Haiqing Zheng, Yan Wang, Suqi Deng, Leisi Zhang, Xutao Guo*
Department of Hematology, Nanfang Hospital, Southern Medical University, Guangzhou Guangdong

Received: Jul. 17th, 2017; accepted: Aug. 4th, 2017; published: Aug. 10th, 2017

ABSTRACT
Objective: Acute myeloid leukemia (AML) is a heterogeneous disease, in terms of genetic/mole- cular abnormalities resulting into marked differences in outcome. We had demonstrated that MDR1, BAALC expression were of prognostic significance and high MDR1 expression correlated with a high BAALC expression in intermediate-risk AML in the prophase study. We founded that MDR1 and BAALC expression together would better identify the patient’s risk profile. Methods: Pretreatment bone marrow samples from 105 adult intermediate risk group AML (IR-AML) patients were analyzed for MDR1 and BAALC mRNA expression by real-time reverse transcriptase polymerase chain reaction. Patients were divided into different groups according to MDR1 and BAALC levels and were compared for clinical outcome. Results: 83 cases of 105 IR-AML patients got CR after the first block with a CR rate being 79.0%. However, 32 cases of the CR patients with IR-AML relapsed with the relapsed rate being 38.6%. On the basis of MDR1 and BAALC expression status, we identified four different subgroups: low MDR1/low BAALC (N = 35), low MDR1/high BAALC (N = 17), high MDR1/low BAALC (N = 17), and high MDR1/high BAALC (N = 36). Patients with high expression of MDR1 and/or BAALC were characterized by an inferior outcome with no significant differences between the three groups; thus, these patients were considered a single group. Patients with low MDR1/low BAALC had a superior CR rate (91.4% vs 72.9%, P = 0.028), OS (79.7% vs 25.3%, P = 0.000) and lower relapse rate 15.6% vs 52.9%, P = 0.001) than high MDR1 and/or high BAALC expression in IR-AML. Conclusion: The combined assessment of BAALC and MDR1 expression can improve treatment stratification in adult IR-AML. Low expression of both MDR1 and BAALC identifies IR-AML patients with a favorable long-term outcome.
Keywords:Acute Myeloid Leukemia, MDR1, BAALC
联合检测中危组成人急性髓系白血病患者MDR1与BAALC基因mRNA表达水平 及其临床意义
史鹏程,郑海青,王焱,邓素琪,张雷丝,郭绪涛*
南方医科大学南方医院血液科,广东 广州

收稿日期:2017年7月17日;录用日期:2017年8月4日;发布日期:2017年8月10日

摘 要
急性髓系白血病(Acute myeloid leukemia, AML)是高度异质性疾病,存在多种具有不同功能的临床意义的基因或分子学异常。我们已经证明了MDR1、BAALC基因均为AML重要的独立预后指标。但是联合检测这两个指标对于中危组AML预后的意义尚未进行阐述。方法:使用实时定量PCR方法检测105例初治成人中危组AML的骨髓标本中MDR1和BAALC基因mRNA水平。将AML患者根据两个基因表达水平分别分为高表达组和低表达组,并统计分析两组病例中临床预后间差异。结果:105例中危组AML中首次诱导化疗后CR率为79.0% (83/105),复发率为38.6% (32/83)。根据MDR1和BAALC基因表达情况,将105例患者分为4组。MDR1基因和BAALC基因均高表达组、MDR1基因高表达而BAALC基因低表达组、MDR1基因低表达而BAALC基因高表达组、MDR1基因和BAALC基因均低表达组。前三组间病人的一般情况及预后资料之间无统计学差异,因此将后组合并为一个组,即高MDR1和/或高BAALC基因表达组。低MDR1/低BAALC患者的CR率(91.4% vs 72.9%, P = 0.028)和OS (79.7% vs 25.3%, P = 0.000)明显高于高MDR1和/或高BAALC基因高表达组,而复发率明显低于MDR1和/或BAALC基因高表达组(15.6% vs 52.9%, P = 0.001)。结论:联合检测MDR1和BAALC基因表达有助于提高成人中危组AML的分层级预后判断,低MDR1/低BAALC的AML患者预后较好。
关键词 :急性髓系白血病,MDR1,BAALC

Copyright © 2017 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
成人急性髓系白血病中大约有45%的患者的染色体核型为正常,但是这组病例呈高度异质性。正常AML已发现有许多的基因或分子学异常与预后密切相关。现已经找到许多重要的预后因素,如FLT3 (Fms-like tyrosine kinase 3,提示预后不良的因素)、NPM1 (nucleophosmin 1)以及CEBPA (CCAAT enhancer-binding protein-ALPHA)等。而某些基因的高表达如MDR1和BAALC等也已有报道其与AML预后不佳密切相关 [1] [2] 。
BAALC基因位于染色体8q22.3,具有高度保守的基因序列和表达模式。BAALC在神经外胚叶和造血发育过程中起着重要作用。在造血细胞中,BAALC仅表达在造血祖细胞,而在成熟的骨髓细胞和外周血中未表达。而在某些ALL的亚型以及正常核型AML中可发现BAALC高表达,与提示预后不佳。高BAALC表达AML患者CR率低,OS较低 [3] [4] 。我们前期研究发现BAALC可以通过影响白细胞细胞的增殖和凋亡来导致其出现耐药 [3] 。
MDR1是白血病化疗药物耐药的主要介质,可产生渗透性糖蛋白P-gap。MDR1基因的表达与细胞抑制类药物细胞骨保留有关,导致白细胞细胞耐药。研究显示MDR1基因表达水平与白血病病人的治疗反应及生存相关 [3] 。
本研究中,我们用实时定量PCR方法联合检测105例NCCN分层为中危组初治AML患者骨髓中MDR1和BAALC基因的表达水平,并分析其临床意义。
2. 材料与方法
2.1. 标本来源
收集2004年1月至2012年1月南方医科大学南方医院血液科按NCCN确诊为中危组的105例初治AML的骨髓标本。核型分析采用染色体G显带技术或间期荧光原位杂交(FISH)技术。因M3具有独特的预后和治疗策略,本研究未分析M3病例。入组的病人年龄为18~65岁。治疗方案:AML患者诱导化疗方案为蒽环类药物3d (去甲氧柔红霉素8~10 mg/m2或柔红霉素45~60 mg/m2)联合阿糖胞苷100~200 mg/m2 × 7 d的方案;巩固治疗方案为诱导化疗方案或中剂量阿糖胞苷。诊断和疗效标准参照张之南主编的《血液病诊断与疗效标准》 [5] 。
2.2. RNA抽提
收集培养的107个KASUMI-1细胞;应用Trizol (Gibcol产品)提取总RNA,经紫外分光光度计测定A260 nm/A280 nm比值,鉴定RNA纯度及定量后,−80℃冰箱冻存备用。
2.3. 引物和探针的设计合成
从GENEBANK上查找MDR1和BAALC基因碱基序列,所有引物经BLAST验证未见非目的基因扩增,各引物与各探针均不形成二聚体。MDR1上游引物序列5’-CAAGATCCTCCTGCTGGATGA;下游引物序列5’- GAACCA CTGCTTCGCTTTCTG;探针ACGTCAGCCTTGGAC。BAALC上游引物序列:5’-CCATCGAGCCCCGCTACT;下游引物序列5’-CGAGAGCTGGACCCGGGAGACA;探针 CGAGAGCTGGACCCGGGAGACA。采用GAPDH为内参基因,上游引物序列 5’-GAAGGTGAAGGTCGGAGTC,下游引物序列5’-GAAGATGGTGATGGGATTTC,探针 5’-CAAGCTTCCCGTTCTCAGCC。探针5’端标记荧光报告基团FAM,3’端标记不发光的TAMRA基团。引物及探针由广州英骏公司合成。
2.4. 荧光定量PCR标准模板的构建
从KASUMI-1细胞提取的RNA,采用T/A克隆的原理,pUCm-T载体购自TAKARA公司,载体与片段的摩尔比例为1:3,连接、转化到大肠杆菌DH5α,培养阳性克隆并提取质粒,纯化后−20℃保存备用。
2.5. 荧光定量PCR检测MDR1和BAALC基因表达
荧光定量PCR分别扩增MDR1和BAALC基因mRNA,两个基因的扩增体系和条件一致。50 µl反应体积内含AMV/Tfl 5 × 反应缓冲液10 µl,0.2 mM dNTP混合物,特异上下游引物各50 pmol,特异性荧光探针15 pmol,25 mM MgSO4 2 µl、1 mM AMV反转录酶(5 U/µl) 1 µl及Tfi DNA聚合酶(5 U/µl) 1 µl,无核酸酶水及总RNA1 µg,反应条件为 42℃ 30 min反转录后95℃ 3 min,95℃变性10 s,55℃退火30 s,72℃延伸60 s,5个循环后95℃变性5 s,60℃ 30 s,30个循环。反应结束后软件自动计算出mRNA的拷贝数。考虑到各个样本总RNA浓度可能存在差异,最终计算结果采用2−ΔCT值(ΔCT = MDR1/ BAALC-GAPDH)来表达ERG基因的表达水平。
2.6. 统计学方法
由于AML患者相对于正常人群MDR1和BAALC基因普遍高表达,本研究中分别采用AML患者MDR 1和BAALC基因表达量的中位数做为区分MDR1和BAALC基因表达水平高低的界点(cut-off point)。两组计量资料间分布比较用Mann-whitney U test;两组以上计量资料间分布比较用Kruskal-wallis test及Bonferroni test;两变量间相关分析采用Spearman rank correlation test;率的比较采用卡方检验;生存分析采用Kaplan Meier analyses,不同生存曲线间差异采用log-rank test。所有检验以P < 0.05为显著统计学差异,双侧检验。
3. 结果
3.1. 初治中危组AML患者MDR1和BAALC基因的表达水平与临床特征的关系
105例中危组AML患者中位年龄38.0 ± 12.9岁,其中男性53例,女性52例。根据两基因表达水平的中位数为分界点,各自分为高MDR1 (n = 53)、低MDR1 (n = 52)表达组以及高BAALC (n = 53)、低BAALC (n = 52)表达组。初治中危组AML患者中MDR1和BAALC基因高表达组与低表达组间年龄、性别、FAB亚型、外周血WBC、骨髓原始幼稚细胞比例的差异见表1,结果提示其间的差异均无统计学意义(P值均 > 0.05)。
Table 1. Patient demographic and disease characteristics stratified by MDR1 and BAALC expression (n = 105)
表1. AML患者MDR1和BAALC基因表达水平及与临床特征的关系
3.2. 中危组组中低BAALC/高MDR1、高BAALC/低MDR1以及 高BAALC/高MDR1三组的临床预后相似
本研究中MDR1与BAALC基因表达水平两者间存在相关性(r = 0.462, P = 0.000)。为了研究MDR1和BAALC表达水平在中危核型组间的意义,我们根据两者表达水平将本组病例分为四组:高BAALC/高MDR1 (n = 36),低BAALC/低MDR1 (n = 35),低BAALC/低MDR1 (n = 17)以及高BAALC/低MDR1 (n = 17)。如表2和图1所示,低BAALC/高MDR1、高BAALC/低MDR1以及高BAALC/高MDR1三组间在CR率、复发率以及OS间的差异无统计学意义。这三组病例间显示出相似的临床预后,因此我们将这三组合并为高MDR1和/或高BAALC表达组。
3.3. 中危组AML中低MDR1/低BAALC表达的AML患者预后良好
低MDR1/低BAALC表达组与高MDR1和/或高BAALC表达组比较,其CR率更高(91.4% vs 72.9%, P = 0.028),复发率更低(15.6% vs. 52.9%, P = 0.001),如表3。生存分析结果提示低MDR1/低BAALC表达组的OS明显优于高MDR1和/或高BAALC表达组 (79.7% vs 25.3%, P = 0.000),如图2。
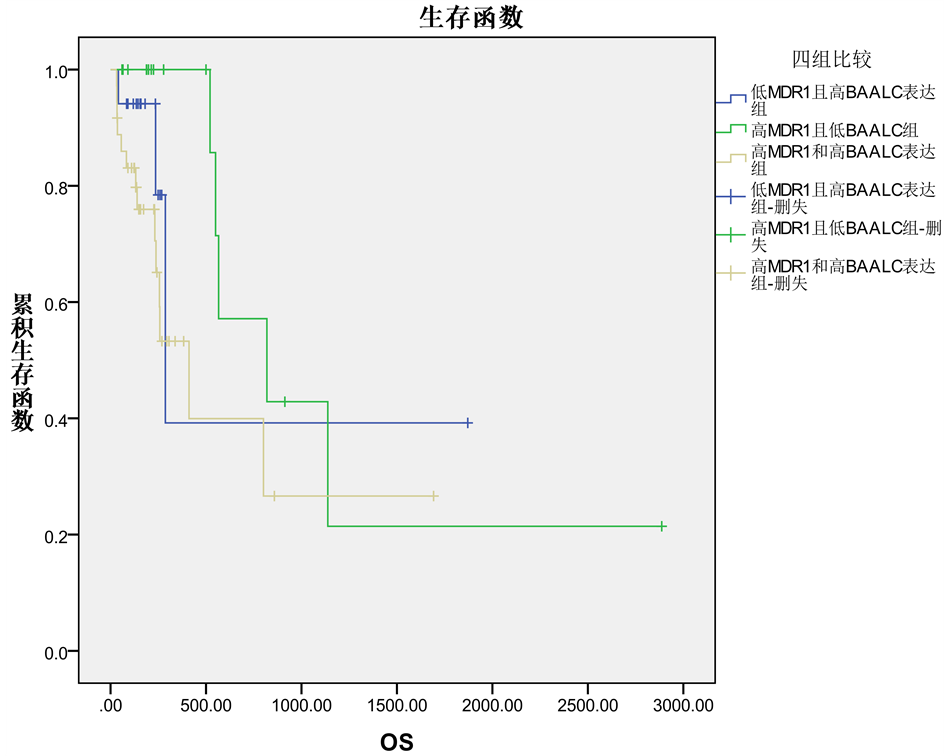
Figure 1. Kaplan-Meier analyses of overall survival (OS) showing not statistical difference among three groups (low MDR/high BAALC, high MDR/low BAALC, high MDR/high BAALC) in IR-AML
图1. Kaplna Meier分析AML高MDR1/低BAALC组、高MDR1/低BAALC以及高MDR1/高BAALC表达水平病例的生存曲线图
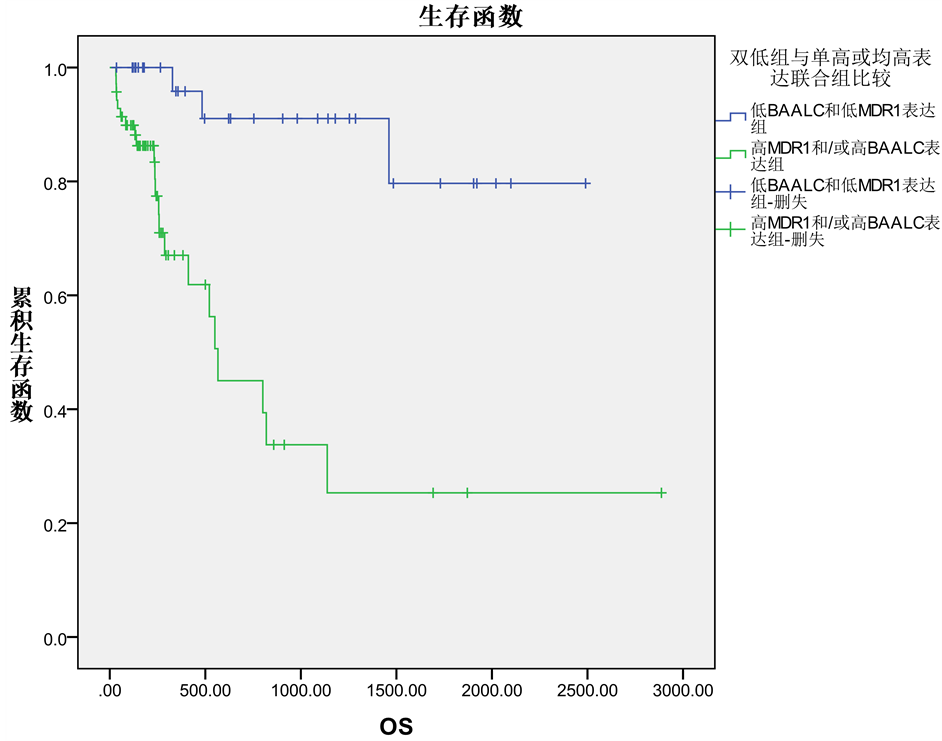
Figure 2. Kaplan-Meier analyses of overall survival (OS) showing a favorable outcome for patients with low MDR1/low BAALC compared with patients with high MDR1 and/or high BAALC expression
图2. Kaplna Meier分析AML患者低MDR1/低BAALC组与高MDR1和/或高BAALC表达组病例的生存曲线图
Table 2. Patients with high MDR1 or BAALC expression in intermediate-risk group demonstrated a similar clinical outcome
表2. 中危组组中高MDR1和/或高BAALC表达组间临床预后相似
*低MDR1/高BAALCvs高MDR1/低BAALC, P(CR) = 0.697; P(复发率) = 0.821;&高MDR1/低BAALC vs高MDR1/高BAALC, P(CR) = 0.743; P(复发率) = 0.821;#低MDR1/高BAALC vs高MDR1/高BAALC, P(CR) = 0.902; P(复发率) = 0.632。
Table 3. Low MDR1/low BAALC expressers have a better clinical outcome in IR-AML
表3. 中危组AML中低MDR1/低BAALC表达组AML病人预后良好
4. 讨论
目前已证实白血病的发生和发展是多种相关基因表达失常或/和抑癌基因失活所致。例如正常基因突变或缺失、癌基因和耐药基因的异常扩增和表达、抗凋亡基因功能受抑等。由此可见,单个基因的多效性以及多个基因的协同作用和机体免疫因素最终决定白血病发生和发展 [2] 。MDR是最常见的肿瘤耐药现象,多药耐药1基因(Multidrug resistance 1, MDR1)是目前研究较多且研究较为系统的耐药机制相关基因之一 [6] 。BAALC基因定位于染色体8q22.3,正常情况下仅表达于神经外胚层来源组织和CD34+早期造血细胞而不出现在成熟的骨髓细胞,在部分AML、ALL和CML急变期(CML-BP)患者中存在高表达,而在CML慢性期(CML-CP)和慢性淋巴细胞白血病(CLL)则不表达。BAALC基因高表达可以作为一种新的判断预后的分子标志 [6] 。
在此次研究中,我们采用了联合检查的方法,检测了105例初治中危组AML患者的MDR1和BAALC基因表达水平。统计结果显示:中危组AML患者MDR1基因表达水平与BAALC基因表达水平存在相关性。进一步联合检测MDR1和BAALC基因水平,发现两基因不管单一高表达或双高表达组之间的预后均较差,MDR1和BAALC均低表达组预后最好。进一步分析发现MDR1和BAALC均低表达组与核型良好组之间的预后分析结果相近。由于本研究中病例数较少,可能导致结果出现偏差。我们将进一步扩大病例数并延长随访时间以证明我们的结果。
本研究联合检测中危组AML患者骨髓中MDR1和BAALC基因表达水平并分析及与临床预后的意义。我们结果提示中危组AML患者中低MDR1/低BAALC表达组预后良好,提示这组病人在治疗策略上可以更偏向于与预后良好核型AML病人组。
基金项目
本研究由国家青年基金81400104、广东省自然科学基金2014A030313274资助。
文章引用
史鹏程,郑海青,王 焱,邓素琪,张雷丝,郭绪涛. 联合检测中危组成人急性髓系白血病患者MDR1与BAALC基因mRNA表达水平及其临床意义
Combined Detection of MDR1 and BAALC Gene Expression in Intermediate Risk Group Acute Myeloid Leukemia Patients and Their Clinical Implication[J]. 临床医学进展, 2017, 07(03): 183-189. http://dx.doi.org/10.12677/ACM.2017.73030
参考文献 (References)
- 1. Estey, E. (2016) Acute Myeloid Leukemia - Many Diseases, Many Treatments. The New England Journal of Medicine, 375, 2094-2095. https://doi.org/10.1056/NEJMe1611424
- 2. Copelan, E.A., et al. (2015) Use of Molecular Markers to Determine Postremission Treatment in Acute Myeloid Leukemia with Normal Cytogenetics. Hematolo-gy/Oncology and Stem Cell Therapy, 8, 143-149. https://doi.org/10.1016/j.hemonc.2015.09.003
- 3. Guo, X., et al. (2014) Low MDR1 and BAALC Expression Identifies a New Subgroup of Intermediate Cytogenetic Risk Acute Myeloid Leukemia with a Favorable Outcome. Blood Cells, Molecules and Diseases, 53, 144-148.
- 4. Weber, S., et al. (2014) BAALC Expression: A Suitable Marker for Prognostic Risk Stratification and Detection of Residual Disease in Cytogenetically Normal Acute Myeloid Leukemia. Blood Cancer Journal, 4, e173. https://doi.org/10.1038/bcj.2013.71
- 5. 张之南. 血液病诊断与疗效标准[M]. 北京: 科学出版社, 2007.
- 6. Ho, M.M., Hogge, D.E. and Ling, V. (2008) MDR1 and BCRP1 Expression in Leukemic Progenitors Cor-relates with Chemotherapy Response in Acute Myeloid Leukemia. Experimental Hematology, 36, 433-442. https://doi.org/10.1016/j.exphem.2007.11.014
NOTES
*通讯作者。
