Hans Journal of Food and Nutrition Science
Vol.
09
No.
04
(
2020
), Article ID:
38792
,
9
pages
10.12677/HJFNS.2020.94042
蝉花菌丝体对大鼠Gentamicin肾损伤之 保护作用
周柏谊1,叶淑幸1,徐瑞霞1,赵敞2,陈炎炼1,陈劲初1,3,4,5*
1葡萄王生技股份有限公司,台湾 桃园
2上海葡萄王企业有限公司,上海
3国立台湾大学食品科技研究所,台湾 台北
4实践大学食品营养与保健生技学系,台湾 台北
5中原大学生物科技学系,台湾 桃园
收稿日期:2020年11月4日;录用日期:2020年11月19日;发布日期:2020年11月26日

摘要
Gentamicin被用于治疗由革兰氏阴性菌所引起的致命性感染,然而,因gentamicin有较强的肾毒性,能抑制肾脏细胞蛋白质的合成,所以易导致急性肾衰竭的发生。蝉花(Cordyceps cicadae)为名贵传统中药材,具有保护肾功能等多样生理功效。本篇研究分为三个部分,我们首先比较两株虫草属真菌–蝉花及禅草(Cordyceps cicadicola),何者对于gentamicin诱导之急性肾损伤有较好的预防功效;接着,我们评估发酵时间长短对于蝉花之肾脏保护功能有无影响;第三部分则进行蝉花对于gentamicin诱导之急性肾损伤的剂量效应评估。试验期间每日进行实验动物之临床观察并测量动物体重,并于试验结束时取大鼠血液、尿液及脏器进行血清生化学检查、尿液分析及组织病理学检查。试验结果显示,蝉花菌丝体对于gentamicin诱导之急性肾损伤大鼠有良好预防功效。
关键词
蝉花,急性肾损伤,Gentamicin
Cordyceps cicadae Prevents Gentamicin-Induced Renal Injury in SD Rats
Bo-Yi Jhou1, Shu-Hsing Yeh1, Jui-Hsia Hsu1, Chang Zhao2, Yen-Lien Chen1, Chin-Chu Chen1,3,4,5*
1Grape King Bio Ltd., Taoyuan Taiwan
2Shanghai Grape King Enterprise Co., Ltd., Shanghai
3Institute of Food Science and Technology, National Taiwan University, Taipei Taiwan
4Department of Food Science, Nutrition, and Nutraceutical Biotechnology, Shih Chien University, Taipei Taiwan
5Bioscience Technology, Chung Yuan Christian University, Taoyuan Taiwan
Received: Nov. 4th, 2020; accepted: Nov. 19th, 2020; published: Nov. 26th, 2020

ABSTRACT
Gentamicin is an important antibiotic against life-threatening, gram-negative bacterial infections. However, gentamicin nephrotoxicity is one of the most common causes of acute renal failure. Cordyceps cicadae (C. cicadae), one of the most valued traditional Chinese medicines, exhibits a variety of biological activities especially in renal protection. The present study was divided into three parts. We first compared two species of the genus Cordyceps, C. cicadae and Cordyceps cicadicola (C. cicadicola), to see which one is better at preventing gentamicin-induced renal injury. Then we evaluated the effect of fermentation time on the renal protective activity of C. cicadae mycelium. The third part of the study was to determine the dose-dependent relationship of C. cicadae mycelium for preventive agents in gentamicin-induced acute renal failure. Clinical observation of the rats was carried out daily. The body weight was recorded daily. At the end of the study, all rats were sacrificed and the blood, urine and organs were collected for clinical biochemistry, urinalysis and histopathological examination. The results demonstrated preventive effects of gentamicin-induced renal toxicity in rats by C. cicadae mycelium powder.
Keywords:Cordyceps cicadae, Acute Kidney Injury, Gentamicin

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
Gentamicin为目前广泛被使用的胺基醣苷类抗生素,用于治疗由革兰氏阴性菌所引起的致命性感染 [1],但其可能引发的肾毒性,却限制其临床应用,其中,以急性肾小管坏死所造成之急性肾损伤最为常见,但肾小球不受影响 [2] [3]。虽然给药方式由一天数次改为一天一次可降低肾毒性的风险,但gentamicin诱发之急性肾衰竭发生率仍居高不下 [4]。
蝉花(Cordyceps cicadae)为名贵传统中药材,入药已有1600年以上的历史,历史记载比冬虫夏草早了800年,古籍中记载丰富,台湾盛产于新北市三峡区满月圆山的竹林中,民间亦将此素材加入鸡汤炖煮食用。现代药理学研究发现,野生或人工培养的蝉花具有抗肿瘤 [5]、降胆固醇 [6]、调节血糖 [7] [8] 以及保护肾功能 [9] [10] [11] 等多项生物活性。
迄今,已有许多篇动物及临床试验发现,蝉花能有助于减轻各项慢性肾脏疾病之功效。王等人于2000年的研究发现,蝉花可显着改善慢性肾衰竭合并肾小管功能失调病人的肾小管功能 [9]。蝉花之活性成分也同样具有肾功能保护的活性,例如,朱等人于2014年的研究曾报导蝉花中的过氧麦角甾醇可减缓TGF-β1诱发的肾纤维化 [10]。彭等人于2015年也发现蝉花中的另一有效成分N6-(2-Hydroxyethyl) adenosine (HEA)对于由缺血再灌流发生肾脏损伤的小鼠同样具有保护功效 [11]。然而,野生蝉花日趋枯竭,以液态方式培养其菌丝速度快,且可控制发酵条件以增加其有效成分HEA,惟目前尚未有文献探讨蝉花菌丝体是否亦具备如野生蝉花的功效性,因此,本篇研究的目的为评估蝉花菌丝体发酵液冻干粉是否可预防或降低gentamicin诱发的急性肾损伤。
2. 材料与方法
2.1. 蝉花與蟬草菌丝体液体发酵条件
将蝉花与蝉草(Cordyceps cicadicola)接种培养于马铃薯葡萄糖洋菜培养基 (potato dextrose agar, PDA),于25℃恒温培养,每月于无菌操作台进行继代培养,并密封保存。取马铃薯葡萄糖洋菜平板培养基上菌丝体接种于内含1 L培养基(2%葡萄糖、1%酵母萃出物、1%黄豆粉、pH 6.0)的2 L烧瓶中,以转速120 rpm于25℃培养三天,至发酵液呈亮紫色,再将此培养出之菌丝体发酵液接种至500 L内含400 L相同培养基发酵槽中,于25℃培养三天后,再接种到20吨发酵槽中(含16吨相同培养基),于25℃培养三天后加热至100℃三小时,萃出其多糖,再收取其菌丝体发酵液,于55℃减压浓缩,经冷冻干燥及磨粉后,保存于4℃备用。
2.2. 动物饲养
六周龄Sprague-Dawley (SD)大鼠购自财团法人国家实验研究院国家实验动物中心,饲养于耐高压材质(Polycarbonate)大饲育盒中(48.3 × 26.7 × 20.3公分),盒上盖不锈钢笼盖,饲料及饮水置于笼盖上,每盒饲养5只。动物饲养室之环境设定为25℃ ± 2℃、相对湿度维持65%~70%、光照/黑暗比例为12/12小时、饲料饮水不限制。饲料采用PMI 5L65可高压灭菌饲料(5010, Rodent LabDiet, PMI Feeds Inc. St. Louis, Mo, USA,粗蛋白 ≥ 23%,粗脂肪 ≥ 4.5%,粗纤维 ≤ 6%,灰份 ≤ 8%,微量矿物质 ≤ 3%)。
2.3. 筛选虫草属菌株保护肾功能效益之初步研究
六周龄SD经适应一周后,随机分为四组,每组八只:1) 控制组(没有注射gentamicin、也没有喂食蝉花或蝉草);2) Gentamicin组(于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);3) 蝉花组(试验期间每天管喂蝉花菌丝体发酵液冻干粉,剂量为500 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);4) 蝉草组(试验期间每天管喂蝉草菌丝体发酵液冻干粉,剂量为500 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day)。试验期间每天进行临床观察,并记录其体重变化。试验结束当天,将所有动物牺牲并取其血液、尿液及脏器,进行血清生化学、尿液分析及组织病理学检查。
2.4. 评估发酵时间对于蝉花菌丝体肾功能保护活性之影响
六周龄SD经适应一周后,随机分为四组,每组八只:1) 控制组(没有注射gentamicin、也没有喂食蝉花);2) Gentamicin组(于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);3) 蝉花3天组(试验期间每天管喂发酵时间为三天之蝉花菌丝体发酵液冻干粉,剂量为500 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);4) 蝉花7天组(试验期间每天管喂发酵时间为七天之蝉花菌丝体发酵液冻干粉,剂量为500 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day)。试验期间每天进行临床观察,并记录其体重变化。试验结束当天,将所有动物牺牲并取其血液及尿液进行血清生化学检查及尿液分析。
2.5. 进行蝉花对于Gentamicin诱导之急性肾损伤的剂量效应评估
六周龄SD经适应一周后,随机分为六组,每组八只:1) 控制组(没有注射gentamicin、也没有喂食蝉花);2) Gentamicin组(于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);3) 蝉花低剂量组(试验期间每天管喂发酵时间为三天之蝉花菌丝体发酵液冻干粉,剂量为50 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);4) 蝉花中低剂量组(试验期间每天管喂发酵时间为七天之蝉花菌丝体发酵液冻干粉,剂量为150 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);5) 蝉花中高剂量组(试验期间每天管喂发酵时间为七天之蝉花菌丝体发酵液冻干粉,剂量为300 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day);6) 蝉花高剂量组(试验期间每天管喂发酵时间为七天之蝉花菌丝体发酵液冻干粉,剂量为500 mg/kg/day,并于试验第7~14天注射gentamicin,剂量为160 mg/kg/day)。试验期间每天进行临床观察,并记录其体重变化。试验结束当天,将所有动物牺牲并取其血液进行血清生化学检查。
2.6. 组织病理学检查
实验14天后解剖动物,肉眼观察大体肾脏、脾脏及显微镜观察肾脏,有无出现明显的病理学改变。
2.7. 统计学处理
实验结果分析采用SPSS软件进行one-way ANOVA检定,分析动物体重、血清生化学检查、尿液分析等各组别间资料差异性,并以P值小于0.05作为统计差异水平。
3. 结果
3.1. 相对于蝉草,蝉花有较佳之肾功能保护活性
喂食蝉花或蝉草后,动物均未出现明显变化,并全数存活至试验结束,控制组、蝉花组及蝉草组体重皆有持续成长,体重变化并无异常(图1)。经连续临床观察两周,动物均活动自如,毛发光滑,饮食正常(图2),呼吸、鼻、眼、口腔无异常分泌物。图3为试验结束后各组血清生化值之平均值,包括血中尿素氮(blood urea nitrogen, BUN)、血清肌酸酐(serum creatinine)及血清尿酸(serum uric acid)。结果显示试验结束后,gentamicin组、蝉花组及蝉草组的血中尿素氮及血清肌酸酐均显着高于控制组(p < 0.05),但是蝉花组及蝉草组中血中尿素氮及血清肌酸酐的值均显着低于gentamicin组(p < 0.05)。然而,在血清尿酸的部分,除了蝉草组的值显著高于其他组别外,各组间并没有统计上的显着差异。
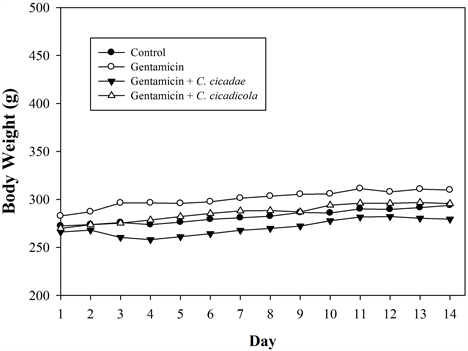
Figure 1. Body weight of rats during the 14-day preliminary study
图1. 初步研究试验期间大鼠之体重变化
Figure 2. Feed intake of rats during the 14-day preliminary study
图2. 初步研究试验期间大鼠之饲料摄取量
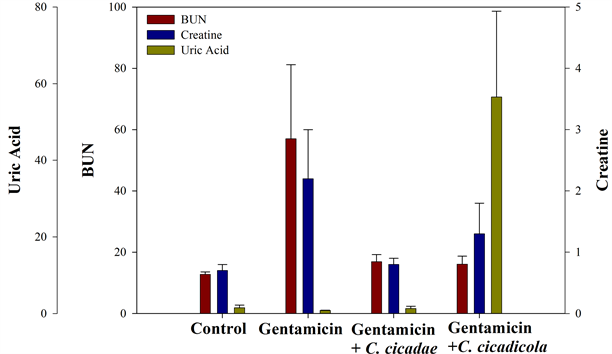
Figure 3. Blood clinical chemistry at the end of the preliminary study
图3. 初步研究试验期间大鼠之血清生化值
图4则为试验结束后各组尿液生化值与尿液常规检查之结果。结果发现gentamicin组尿液中之尿素氮(urine nitrogen)、肌酸酐(urine creatinine)、微白蛋白(microalbumin)及乙酰胺基葡萄糖甘酶(N-acetyl-B-D- glucocaminidase, NAG)均显着高于其他组别。然而,控制组、蝉花组及蝉草组之尿液生化值与尿液常规检查之结果并没有观察到有统计上的组间显着差异。在组织病理学切片检查结果,gentamicin组、而蝉花组及蝉草组均有观察到明显的病理学改变(图5)。
3.2. 发酵时间对于蝉花菌丝体之肾功能保护活性并无影响
图6为试验结束后各组血清生化值之平均值,可看出试验结束后,gentamicin组血中尿素氮、血清肌酸酐及血清尿酸之平均值均显着高于控制组(p < 0.05),然而,试验结束后,控制组、蝉花3天组及蝉花7天组的血中尿素氮、血清肌酸酐及血清尿酸并没有统计上的显着差异。与控制组相比,gentamicin组尿液中之尿素氮、肌酸酐、微白蛋白及乙酰胺基葡萄糖甘酶之平均值均显着较高,但尿酸并无统计上之显著差异;另一方面,控制组、蝉花3天组及蝉花7天组之尿液生化值与尿液常规检查之结果并没有观察到有统计上的组间显着差异(图7)。
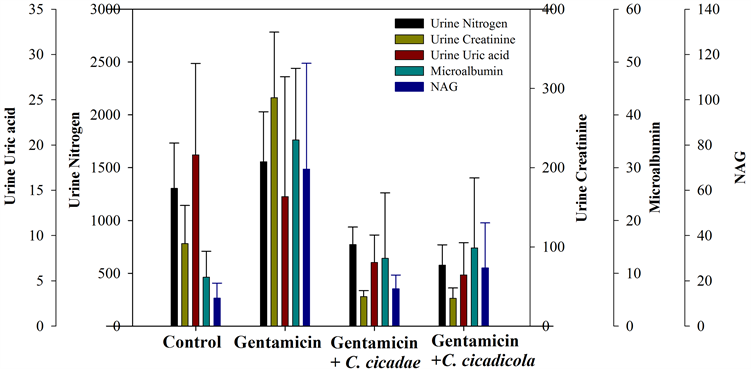
Figure 4. Urine clinical chemistry at the end of the preliminary study
图4. 初步研究试验期间大鼠之尿液生化值与尿液常规检查之结果
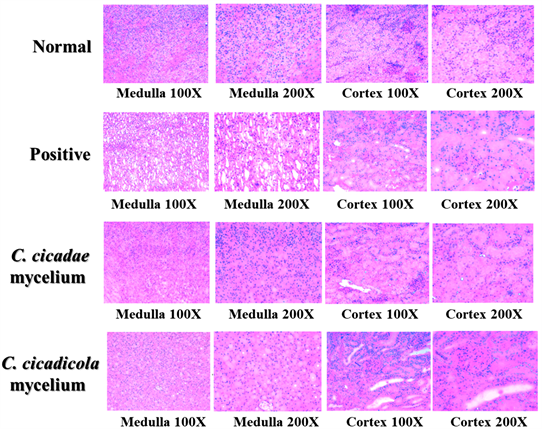
Figure 5. H&E stained section of the kidney of the preliminary study
图5. 初步研究试验期间大鼠肾脏之组织病理学检查结果
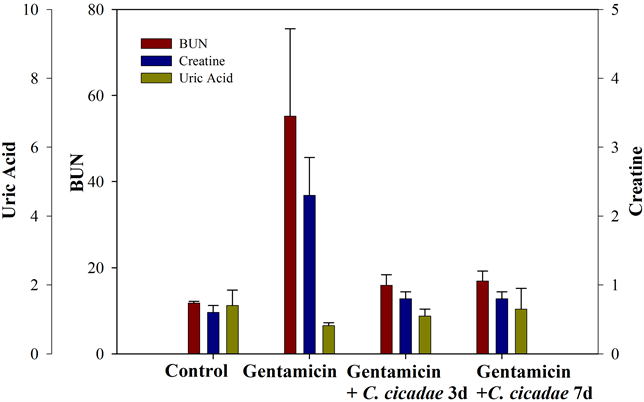
Figure 6. Effect of fermentation time on the blood clinical chemistry
图6. 蝉花发酵时间长短对于大鼠血清生化值之影响
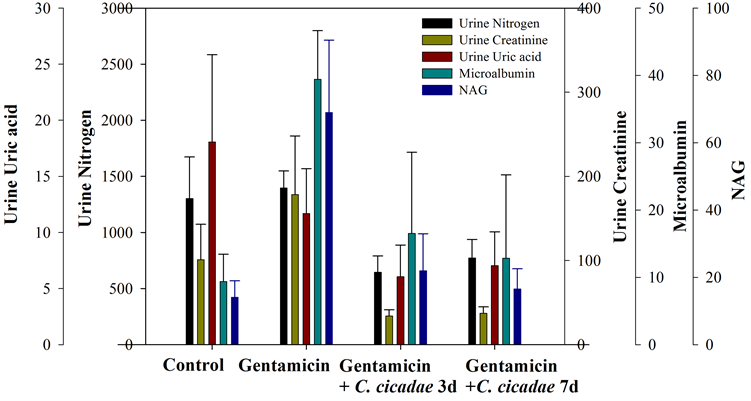
Figure 7. Effect of fermentation time on the urine clinical chemistry
图7. 蝉花发酵时间长短对于大鼠尿液生化值与尿液常规检查之影响
3.3. 蝉花菌丝体可预防gentamicin诱发之肾衰竭,且具有剂量效应
表1为试验结束后各组尿液生化值与尿液常规检查之结果,结果显示管喂不同剂量之蝉花菌丝体发酵液冻干粉可显著且具剂量效应地抑制gentamicin诱发之尿素氮、肌酸酐及尿酸平均值的升高,抑制效果最好的剂量为300 mg/kg/day。
Table 1. Dose-response assessment of Cordyceps cicadae mycelium on the urine clinical chemistry
表1. 不同剂量之蝉花菌丝体发酵液冻干粉对于大鼠尿液生化值与尿液常规检查之影响
*Significant different from control group (p < 0.05). **Significant different from control group (p < 0.01). +Significant different from gentamicin group (p < 0.05). ++Significant different from gentamicin group (p < 0.01).
4. 讨论
虽然因gentamicin用药所导致的肾毒性副作用机制尚未非常清楚,但gentamicin目前仍广泛被用在治疗有致命性之感染,因此,我们致力于找出能预防或推迟此肾毒性副作用的方法。本篇研究所使用的gentamicin剂量为参考先前研究可导致显着肾损伤的剂量为依据,试验期间连续经由静脉注射给予六天剂量为160 mg/kg/day的gentamicin为导致肾损伤所必要的时间,可观察到组织病理学及相关肾脏功能之改变。本篇研究的大鼠经六天的静脉注射gentamicin后,也发现了相较于控制组,相关之血清生化值(包含血中尿素氮、血清肌酸酐及血清尿酸)及尿液生化值(包含尿液中之尿素氮、肌酸酐、微白蛋白及乙酰胺基葡萄糖甘酶)均显着升高,证实我们经由gentamicin诱发之大鼠肾损伤模式是成功的。
我们以20吨槽液态发酵蝉花生产其菌丝体,在1%接种量下,仅三天即能长满,菌丝干重可达1.98%,HEA含量约为3.17 mg/g,干燥后粉末呈褐色,食之无特殊味道及香味。蝉花菌丝体粗成分分析中,粗蛋白含25.38%,粗纤维8.32%,粗脂肪7.72%,灰分4.87%,水分8.92%;而重金属方面,蝉花菌丝体发酵液中其砷、铅、汞、镉含量皆低于天然蝉花 [12]。人工液态培养之菌丝体与天然蝉花的成分相似,且菌种来源稳定,污染少,生产周期短,质量更易掌控,更可提高产能及确保有效成分的再现性。
蝉花或蝉草菌丝体发酵液冻干粉的给予天数为14天,并在静脉注射gentamicin六天前即开始管喂给予,目的为确保身体组织在暴露于gentamicin伤害时能达到足够蝉花或蝉草的剂量水平,以筛选预防急性肾损伤之目标物;之后,我们认为培养天数不同,蝉花之二级代谢产物可能不同,因此以菌丝长满之第三天及菌丝开始裂解之第七天来比较评估蝉花之二级代谢产物对于肾功能保护活性是否有影响;另一方面,由于未知有效剂量,本篇研究先以高剂量来评估蝉花之肾功能保护活性,因此若高剂量具肾功能保护活性,再将剂量降低,并评估其最低有效剂量。在本篇研究的第一部分,各组别间的进食量、体重变化及临床观察并未有显著差异,而于组织病理学切片检查中,观察到getamicin组之肾脏髓质及肾脏皮质明显损伤严重,可能由于尿液于髓质浓缩,而药物蓄积于皮质之关系,而蝉花组及蝉草组之髓质检查结果与控制组较为接近,皮质检查结果则观察到蝉花相较于蝉草受损面积较小,另一方面,血清生化学及尿液检查均能看到蝉花及蝉草逆转了gentamicin造成之相关数值的升高,但蝉草组则有观察到血清尿酸异常升高的状况,综合上述结果,我们推测虫草属的真菌中,蝉花相较于蝉草有较佳的肾功能保护功效,且副作用也较少,因此,我们选择了蝉花来进行接下来的实验。接着在第二部分,实验结果发现发酵时间不同之蝉花菌丝体发酵液冻干粉对于gentamicin诱发之肾脏功能相关之血清生化值及尿液生化值的保护作用并没有显著差异,因此我们认为液态发酵时间并不会影响蝉花之肾功能保护活性;彭等人于2015年的研究发现喂食7.5 mg/kg HEA一周之雄性C57BL/6小鼠可明显改善肾小管上皮细胞的损伤程度 [11],可能由于本篇喂食之测试物并非纯化物,而是菌丝体发酵液冻干粉,尚未达到该活性成分之有效剂量,因此并未观察到由于发酵时间不同而导致之二级代谢物含量不同所造成之影响。最后,我们评估不同剂量的蝉花菌丝体发酵液冻干粉对于gentamicin诱发之尿液生化值改变之保护作用,发现蝉花菌丝体发酵液冻干粉显著抑制了gentamicin肾损伤的发生,剂量–反应曲线以U型呈现,最佳剂量为300 mg/kg/day。
综合以上结果,本篇研究证实蝉花菌丝体发酵液冻干粉可预防并推迟由gentamicin所诱发之SD大鼠肾损伤发生。
文章引用
周柏谊,叶淑幸,徐瑞霞,赵 敞,陈炎炼,陈劲初. 蝉花菌丝体对大鼠Gentamicin肾损伤之保护作用
Cordyceps cicadae Prevents Gentamicin-Induced Renal Injury in SD Rats[J]. 食品与营养科学, 2020, 09(04): 318-326. https://doi.org/10.12677/HJFNS.2020.94042
参考文献
- 1. Ozbek, E., Cekmen, M., Ilbey, Y.O., et al. (2009) Atorvastatin Prevents Gentamicin-Induced Renal Damage in Rats through the Inhibition of p38-MAPK and NF-kB Pathways. Renal Failure, 31, 382-392. https://doi.org/10.1080/08860220902835863
- 2. Reiter, R.J., Tan, D.X., Sainz, R.M., et al. (2002) Melatonin: Reducing the Toxicity and Increasing the Efficacy of Drugs. Journal of Pharmacy and Pharmacology, 54, 1299-1321. https://doi.org/10.1211/002235702760345374
- 3. Pedraza-Chaverrı́, J., González-Orozco, A.E., Maldonado, P.D., et al. (2003) Diallyl Disulfide Ameliorates Gentamicin-Induced Oxidative Stress and Nephropathy in Rats. European Journal of Pharmacology, 473, 71-78. https://doi.org/10.1016/S0014-2999(03)01948-4
- 4. Ferriols-Lisart, R. and Alos-Alminana, M. (1996) Effective-ness and Safety of Once-Daily Aminoglycosides: A Meta-Analysis. American Journal of Health-System Pharmacy, 53, 1141-1150. https://doi.org/10.1093/ajhp/53.10.1141
- 5. Ukai, S., Kiho, T., Hara, C., et al. (1983) Polysaccharides in Fungi. XIII. Antitumor Activity of Various Polysaccharides Isolated from Dictyophora indusiata, Ganoderma japon-icum, Cordyceps cicadae, Auricularia auricula-judae, and Auricularia Species. Chemical and Pharmaceutical Bulletin, 31, 741-744. https://doi.org/10.1248/cpb.31.741
- 6. Koh, J.H., Kim, J.M., Chang, U.J., et al. (2003) Hypocho-lesterolemic Effect of Hot-Water Extract from Mycelia of Cordyceps sinensis. Biological and Pharmaceutical Bulletin, 26, 84-87. https://doi.org/10.1248/bpb.26.84
- 7. Song, J.M., Xin, J.C. and Zhu, Y. (2007) Effect of Cordyceps cica-dae on Blood Sugar of Mice and Its Hematopoietic Function. Chinese Archives of Traditional Chinese Medicine, 25, 1144-1145.
- 8. Jhou, B., Hsu, J. and Yeh, S. (2016) A Subacute Toxicity Study of Cordyceps cicadae Mycelium in High-Glucose Diet-Fed LY Pigs. Hans Journal of Food and Nutrition Science, 5, 13-20. https://doi.org/10.12677/HJFNS.2016.52002
- 9. Wang, H.Y. and Chen, Y.P. (2000) Experience in Using Cordyceps cicadae by Professor Yi-Ping Chen. Chinese Journal of Information on Traditional Chinese Medicine, 7, 71.
- 10. Zhu, R., Zheng, R., Deng, Y., et al. (2014) Ergosterol Peroxide from Cordyceps ciacadae Ameliorates TFG-β1-Induced Activation of Kidney Fibroblasts. Phytomedicine, 21, 327-378. https://doi.org/10.1016/j.phymed.2013.08.022
- 11. Peng, X.X., Chai, Y.Q., Zhu, B.C., et al. (2015) The Protective Effects of N6-(2-Hydroxyethyl)-Adenosine Extracted from Ophiocordyceps sobolifera on Renal Ischemia Reperfusion Injury (IRI) in Mice. Mycosystema, 34, 311-320.
- 12. Hsu, J.H., Yeh, S.H., Huang, W.C., et al. (2015) Isolation, Iden-tification and Genotoxicity Test of Cordyceps cicadae Mycelium. Journal of Testing and Quality Assurance, 4, 114-127.
NOTES
*通讯作者。
