Open Journal of Nature Science
Vol.04 No.02(2016), Article ID:17538,7
pages
10.12677/OJNS.2016.42019
Study on DNA Extraction Methods for Minute Touch Biological Samples
Yirun Huangfu1, Xin Meng2, Xiaojiang Yang1, Chenxi Cao1, Li Huang1*
1Jiangsu Police Institute, Nanjing Jiangsu
2The Xuanwu Police Security, Nanjing Municipal Public Security Bureau, Nanjing Jiangsu

Received: Apr. 25th, 2016; accepted: May 9th, 2016; published: May 13th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
“TES solution two-step extraction method”, “NaCl solution two-step extraction method” and “Double-sided adhesive paste method” are three methods we used to detach and transfer cells. Our goal is to examine and compare the test results among three detaching methods above so that we are able to provide references for optimizing the extraction method in the future. Method: After applying three cell extraction methods above to 168 sweat samples located on glasses, aluminum, plastic and wood, we can use Chelex method or silicon bead test to extract the DNA from these samples. Furthermore, after applying PCR amplification, routine STR testing, we are able to validate the test result using fingerprints. Result: “NaCl solution two-step extraction method” combined with silicon bead test is the best biomaterial extraction method and it is capable for public security practice.
Keywords:Microscale, Contact (Touch), Biomaterial (Biological Samples), The Transfer of Cell Detach, DNA Extractions

微量接触性生物检材提取方法研究
皇甫一润1,孟昕2,杨晓蒋1,曹晨曦1,黄莉1*
1江苏警官学院,江苏 南京
2南京市公安局玄武分局刑大,江苏 南京

收稿日期:2016年4月25日;录用日期:2016年5月9日;发布日期:2016年5月13日

摘 要
目的:对TES溶液二步提取法、NaCl溶液二步提取法以及双面胶粘贴法三种脱落细胞转移方法和Chelex法、硅珠法两种DNA提取方法的检验效果进行比较,为优化提取方法提供参考。方法:168例汗斑样本在玻璃、铝板、塑料、木板四种客体上,分别用上述3种脱落细胞转移方法后,采用硅珠法和Chelex法提取后,PCR扩增,常规STR检测,并采用手指印进行验证实验。结果:NaCl溶液二步提取法结合硅珠法DNA提取方法能获得最佳的生物检材的提取效果,并可应用于公安办案实践。
关键词 :微量,接触性,生物检材,脱落细胞转移,DNA提取

1. 引言
接触性生物检材是指含有人体皮肤粘膜脱落细胞的生物检材。越来越多的案件表明,随着犯罪嫌疑人的反侦察意识的增强,案件现场所遗留的明显的生物物证(如精斑、血迹、毛发、人体组织等)常常被有意识的破坏,于是,一些容易被犯罪嫌疑人忽视的微量接触性生物物证常常成为案件侦破的关键线索。根据笔者统计的南京市2014年全年7589个微量接触性生物检材样本来看,口腔脱落上皮细胞样本(包括烟头、杯瓶口、餐具、吸管、牙刷、食物等)2881例,检出率达80.22%;而皮肤脱落上皮细胞样本(所在客体为塑料、金属、玻璃、木材等非渗透性客体)4708例,检出率仅为8.73%。从以上数据可以看出,含有口腔脱落上皮细胞的检材检出率较高,而含有皮肤脱落上皮细胞的检材检出率很低,因此本文主要探讨含有在非渗透性载体上的皮肤脱落上皮细胞的检材的提取方法及其提取效率。
微量接触性生物检材含有的DNA往往是微量的,属于低拷贝数目模板 [1] 。微量DNA即低拷贝数量模板检测通常是指起始DNA少于100 pg,或者低于15个二倍体细胞的分析实验 [2] 。本课题组采用PCR扩增技术和STR检测分析对不同变量的属于低拷贝数目模板的微量接触性生物检材中DNA的质和量进行了比较研究。变量分别是4种不同客体,3种不同的脱落细胞转移方法,2种DNA提取方法提取。找出了最佳的微量生物检材提取方法和DNA提取方法,并加以实验验证。
2. 实验材料及仪器
2.1. 实验材料及试剂
无漆光滑铝板,光滑塑料板,光滑玻璃板,漆面实木地板,0.9%氯化钠注射液(安徽丰原药业股份有限公司),明庭双面胶(深圳市奇富特包装材料有限公司)。
三羟甲基氨基甲烷,(Tris base美国SIGMA公司,>99%),浓盐酸(分析纯,成都市科龙化工试剂厂,36.0%~38.0%),EDTA.Na2·2H2O(美国Promega公司,>99%),氯化钠(美国SIGMA公司,>99%),十二烷基硫酸钠(SLS,美国BIOSHARP公司,>94%),二硫苏糖醇(DTT,美国SIGMA公司,>99%),Chelex—100 (美国SIGMA公司,>99%),蛋白酶K溶液(PK,美国SIGMA公司),异硫氰酸胍(GuSCN,美国SIGMA公司,>94%),硅珠(美国SIGMA公司,>99%),聚乙二醇辛基苯基醚(Triton X-100,美国SIGMA公司),75%乙醇溶液(分析纯,无锡市亚盛化工有限公司,>99%),Identifiler Plus试剂盒(美国AB公司),LIZ-500(美国AB公司),去离子甲酰胺溶液(美国AB公司),超纯水。
2.2. 溶液的配制
以下溶液均由2.1中试剂配置。
2.3. 实验仪器
ETC-811PCR扩增仪(东胜业兴科学仪器有限公司),GeneAmp PCR System 9700扩增仪(美国AB公司),3500XL基因测序仪(美国AB公司),PICO17台式高速离心机(美国Thermo Scientific公司),Labofuge400平板离心机(美国Thermo Scientific公司),P系列单道移液器(法国GILSON公司),HTLS121八道移液器(波兰HTL公司),EPED-Z1-20T实验室级纯水器(南京益普达科技发展有限公司),Milli-Q Reference纯水仪(美国MERCK MILLIPORE公司)。
3. 实验内容
3.1. DNA的提取
3.1.1. 实验样本的制备
汗斑样本均来自同一人,通过自然滴落的方式收集汗液。汗液收集后4℃保存。
将无漆光滑铝板,光滑塑料板,光滑玻璃板,漆面实木地板这四种实验客体用84消毒液清洗后,再用水洗净晾干。将上述汗液滴各取20 μL滴落在上述四种客体上,用吹风机吹干成为汗斑,每种客体上制作42个汗斑样本,每7个样本为一组。每种客体上每两组汗斑样本分别用TES溶液二步提取法、0.9%NaCl溶液(下简称NaCl溶液)二步提取法和双面胶粘贴法转移检材,之后将使用同一种转移方法的两组样本分别用Chelex法和硅珠法提取DNA。
3.1.2. 脱离细胞的转移
(1) TES溶液二步提取法
用蘸有15 μLTES溶液的医用棉签擦拭汗斑,然后再用干医用棉签擦拭汗斑所在部位,剪下干、湿两支棉签擦拭部位的棉签头,放入试管中。
(2) NaCl溶液二步提取法
用蘸有15 uLNaCl溶液的医用棉签擦拭汗斑,然后再用干医用棉签擦拭汗斑所在部位,剪下干、湿两支棉签擦拭部位的棉签头,放入试管中。
(3) 双面胶粘贴法
用剪成10 mm × 6 mm的双面胶接触汗斑,然后将双面胶放入试管时避免含有脱落细胞的一面与其他地方粘在一处,造成脱落细胞损失。
3.1.3. 样本DNA的提取
(1) Chelex法
将Chelex-100悬浊液振荡后加入50 µL 至玻璃试管中。将试管先以56℃恒温加热1 h,再以99℃加热15 min。将试管以12,000 rpm的转速离心2 min,取上层清液,转移到新反应板中,等待PCR扩增。
(2) 硅珠法
将60 µL的消化液加入玻璃试管中,先在56℃下恒温加热1 h,再以99℃加热15 min。再加150 µL吸附液至试管中,涡旋振荡,以12,000 rpm的转速离心2 min,将上层清液转移入新管,并加入15 µL硅珠悬浊液,涡旋振荡后静置15 min。将试管或反应板12,000 rpm离心2 min,然后弃上清液。再加入200 µL 75%冰冷乙醇溶液,以12,000 rpm的转速离心2 min后弃上清液,并重复两次。将反应板烘干,加50 µL超纯水,振荡混匀,在56℃下脱浴20 min,等待PCR扩增。
3.2. DNA的扩增与检测
3.2.1. PCR扩增
将待扩增样品以12,000 rpm的转速离心2 min,取上层清液6 µL于反应板,再加入9 µL Identifiler Plus扩增试剂中,混匀后离心,并放入9700扩增仪中按照Identifiler Plus试剂盒推荐的程序进行28次循环PCR扩增。
3.2.2. 结果检测
取扩增产物1 µL加入到10 µL检测液中,在其余的10 µL检测液中加入1 µL ladder,放入基因测序仪,最后通过GeneMapper ID-X软件将检测结果进行数据分析。
3.3. 验证
在用84消毒液洗净、晾干的光滑铝板划分出7个面积相同的区域,每次用一根手指在一个区域中按住并滚动达10秒钟,以此做出10个样本,用NaCl溶液二步提取法转移脱落细胞,然后使用硅珠法提取10个样本中的DNA,之后分别对各组提取待用的DNA模板进行扩增后进行结果检测,并通过GeneMapper ID-X软件进行数据分析。
4. 结果与讨论
4.1. 168个样本检测结果
对无漆光滑铝板,光滑塑料板,光滑玻璃板,漆面实木地板这四种客体上的各42个汗斑样本分别用TES溶液二步提取法、NaCl溶液二步提取法和双面胶粘贴法转移脱落细胞,之后将使用同一种转移方法的两组样本分别用Chelex法和硅珠法提取DNA。经PCR扩增,得到的检测结果,笔者得到了各种变量相同的每组中7个(每个样本16组等位基因的)平均峰面积:
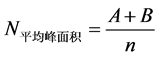
式中A为13个杂合子的26个峰面积之和,B为3个纯合子峰面积之和,n = 16;以及基因型数:

式中C为检测出的杂合子数,D为检测出的纯合子数。
将上述两者进行统计,得到每组的组平均峰面积(每组的7个平均峰面积的平均值)、组峰面积相对标准差(每组的7个平均峰面积的相对标准差)及组平均基因型数(每组的7个基因型数的平均值)。使用Chelex法的84个样本结果见表1,使用硅珠法的84个样本结果见表2。
4.2. 验证结果
根据表1、表2中168个样本的数据得出的结论,在客体为铝板时,使用NaCl溶液二步提取法和硅珠法DNA提取效果最佳。遂选用铝板,使用NaCl溶液二步提取法和硅珠法进行验证实验。笔者将得到的该组10个样本的16个位点的平均峰面积(同前)及基因型数(同前)进行统计,得到该组的基因型检出率:
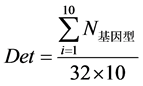
分析结果见表3。
4.3. 讨论
4.3.1. 在同一客体表面不同脱落细胞转移方法比较
根据表1和表2可以得到:在玻璃表面,TES溶液二步提取法效果最佳,总平均峰面积(在该客体上和转移方法时,Chelex法中组平均峰面积值与硅珠法中组平均峰面积的平均值,下同)为2147.785,总平
Table 1. Each sample group’s group average peak area, relative standard deviation and group average number of Genotype by using Chelex method
表1. 使用Chelex法的各组样本组平均峰面积、相对标准差及组平均基因型数
Table 2. Each sample group’s group average peak area, relative standard deviation and group average number of Genotype by using silicon bead test
表2. 使用硅珠法的各组样本组平均峰面积、相对标准差及组平均基因型数
Table 3. The validation group’s average peak area, number of Genotype and detection rate
表3. 验证组的平均峰面积、基因型数及检出率
均基因型数(在该客体上和转移方法时,Chelex法中组平均基因型数与硅珠法中组平均基因型数的平均值,下同)为30.07,其两个组峰面积相对标准偏差数据与其他转移方法的相比最小。在铝板、塑料以及木板表面,NaCl溶液二步提取法效果最佳,总平均峰面积分别为2478.500、2381.855、1930.285,总平均基因型数分别为27.65、27.36、24.36,其两个组峰面积相对标准偏差数据与其他转移方法的相比较小。总体而言,使用NaCl溶液二步提取法的效果相对较好,平均峰面积数值较大,多组的数值也较为稳定(组相对标准偏差较小),等位基因所检出的位点较为完整。
4.3.2. 在同一客体表面不同DNA提取方法比较
根据表1和表2可以得到:在玻璃、铝板、塑料以及木板表面,硅珠法效果最佳,总平均峰面积(在该客体上和提取方法时,TES溶液二步提取法中组平均峰面积、NaCl溶液二步提取法中组平均峰面积和双面胶粘贴法中组平均峰面积的平均值)分别为2113.007、2835.620、2665.857、2149.000,总平均基因型数(在该客体上和提取方法时,TES溶液二步提取法中组平均基因型数、NaCl溶液二步提取法中组平均基因型数和双面胶粘贴法中组平均基因型数的平均值)分别为27.19、30.48、29.52、28.86,其三个组峰面积相对标准偏差数据与另一个提取方法的相比相对较小。总体而言,使用硅珠法的效果相对较好,平均峰面积数值较大,多组的数值也较为稳定(组相对标准偏差较小),等位基因所检出的位点较为完整。
4.3.3. 不同脱离细胞转移方法和DNA提取方法的探讨
由表1和表2的数据表明,使用Chelex法的84个样本总体的平均峰面积小于使用硅珠法的平均峰面积,与杨电的结论相吻合 [3] :Chelex法的缺点是提取的DNA纯度不高,容易出现等位基因扩增不平衡、甚至小片段优势扩增导致大片段等位基因缺失现象。但是使用双面胶粘贴法的Chelex法的样本检测效果优于使用双面胶粘贴法的硅珠法,原因可能是Chelex法提取到的双面胶上脱落细胞的DNA量较多,而硅珠法由于提取步骤较多,DNA损失较大。
在使用Chelex法时,使用双面胶粘贴法的样本与使用另外两种转移方法的样本相比,整体而言,平均峰面积值较大,等位基因位点较为完整。在使用硅珠法时,使用双面胶粘贴法效果最差,等位基因位点缺失较为严重;使用NaCl溶液二步提取法与TES溶液二步提取法,效果均较好,而NaCl溶液二步提取法效果更胜一筹,原因可能是生理盐水模拟了人体环境,能够更好的保存脱落细胞。
4.3.4. 验证结果的探讨
由表3的数据我们可以看到,验证实验中,等位基因位点较为完整,十个样本总体的基因型检出率较高,达到了预期效果,适合公安机关的办案实践。由于在验证实验中,采用的是指纹中的脱落细胞,无法定量,也无法保证其细胞数达到汗斑中的数量。
5. 结论
通过大量的实验比较,最后通过模拟现场的试验验证,DNA检测结果以NaCl溶液二步提取法和硅珠法最佳,不仅平均峰面积数值较大,检测的稳定性也较高,等位基因所检出的位点较为完整,缺失很少,比较适合应用于公安机关犯罪现场微量生物性接触检材的转移和提取。
致谢
感谢南京市公安局玄武分局DNA实验室提供的帮助和支持。
基金项目
江苏省高等学校大学生实践创新训练计划一般项目,项目编号:20150329033Y;江苏高校优势学科建设工程资助项目(PAPD);江苏省“十二五”一级学科省重点建设学科资助项目。
文章引用
皇甫一润,孟 昕,杨晓蒋,曹晨曦,黄 莉. 微量接触性生物检材提取方法研究
Study on DNA Extraction Methods for Minute Touch Biological Samples[J]. 自然科学, 2016, 04(02): 156-162. http://dx.doi.org/10.12677/OJNS.2016.42019
参考文献 (References)
