 Hans Journal of Biomedicine 生物医学, 2012, 2 19-22 http://dx.doi.org/10.12677/hjbm.2012.23005 Published Online July 2012 (http://www.hanspub.org/journal/hjbm) Anti-Tumor Activity of the Peptide from Bullacta exarata Huanle Lin, Zhiyi Li, Bo Chen, Zhongda Yi, Zefeng Wang, Jianyin Ma* School of Food and Pharmacy, Donghai Science and Technology College, Zhejiang Ocean University, Zhoushan Email: *chymjy@zjou.edu.cn Received: May 30th, 2012; revised: Jun. 29th, 2012; accepted: Jul. 5th, 2012 Abstract: Objective: To isolate and purify the peptide from Bullacta exarata, and study its anti-tumor effect on prostate cancer. Methods: The antimicrobial peptides were hydrolyzed from soft tissues of Bullacta exa rata by trypsin, and purified by sephadex chromatography. Measured by MTT assay in vitro anti-tumor activity and cell morphology was observed by fluorescence staining. Results: The components separated from membrane (molecular weight 5 - 10 KD)and isolated by the Sephadex G-75 could inhibitse the PC-3 cells growth, and the latter stronger than the former. Conclusion: The Bullacta peptides could inhibitse the PC-3 cells growth and have anti-tumor activities on prostate cancer. Keywords: Peptides of Bullacta Exarata; Anti-Tumor; Enzymatic; Prostate Cancer 泥螺多肽抗肿瘤活性的初步研究 林焕乐,励芝伊,陈 博,易忠达,王泽峰,马剑茵* 浙江海洋学院东海科学技术学院食品与药学系,舟山 Email: *chymjy@zjou.edu.cn 收稿日期:2012 年5月30 日;修回日期:2012年6月29日;录用日期:2012 年7月5日 摘 要:目的:提取分离泥螺软体组织,探索其体外抗肿瘤活性。方法:采用胰蛋白酶酶解法获得泥螺多肽粗 提物,通过超滤膜滤过技术获得分子量在5~10 kDa的组分。用葡聚糖凝胶G-75 分离、纯化,MTT 法测定其体 外抗肿瘤活性并用荧光染色法观察细胞形态。结果:经膜分离得到的组分(分子量 5~10 KD)和经葡聚糖凝胶 G-75 分离得到的泥螺多肽对前列腺PC-3 肿瘤细胞均有一定的抑制作用,且后者强于前者。结论:泥螺多肽具有一定 的抗前列腺PC-3 肿瘤细胞的活性。 关键词:泥螺多肽;抗肿瘤;酶解;前列腺癌 1. 引言 泥螺(Bullacta exarata),俗称“吐铁”、“黄泥螺”、 “梅螺”等[1],隶属于腹足类后鳃亚纲软体动物,由 贝壳和软体两部分组成,为西太平洋沿岸半咸水滩涂 的习见种类,广泛分布于我国南北沿海潮间带滩涂, 是典型潮间带底栖匍匐动物,多栖息在中底潮带,泥 沙或沙泥的滩涂上,在风浪小、潮流缓慢的海湾中尤 其密集,以东海和黄海产量最多。其生物体内蛋白含 量丰富,多肽物质丰富。 一些生物活性多肽常以非活性状态存在于蛋白 质中,这些蛋白质经过蛋白酶的水解作用,使隐藏于 其中的活性肽释放出来,有可能发挥出比蛋白更多的 生物活性[2-4]。当今社会,人们受肿瘤的严重危害,寻 找低毒、高效的抗肿瘤药物迫在眉睫。而海洋物质丰 富,近年来有报道海洋天然活性成分具有一定的抗肿 瘤活性[5,6]。本文以新鲜的泥螺软体组织为对象,提取 分离了不同分子量的泥螺活性多肽,并对分子量在 5~10 kDa 的组分进行体外抗肿瘤活性的初步研究,为 *通讯作者。 Copyright © 2012 Hanspub 19  泥螺多肽抗肿瘤活性的初步研究 抗肿瘤药物的研发提供参考。 2. 材料与仪器 2.1. 材料 泥螺,购于舟山南珍菜场。胰蛋白酶(国药集团化 学试剂有限公司);葡聚糖凝胶 G-75(Pharmacia);其 余试剂均为分析纯。 2.2. 主要仪器 BSA124S 型电子天平(德国,Sartorius AG公司); DS-1 型高速组织捣碎机(上海标本模型厂);高速冷冻 离心机 CF16RXII( 日立 HITACHI公司);TG16-WS 台 式高速离心机(长沙湘智离心机仪器有限公司); SHB-III A循环水式多用真空泵(郑州长城科工贸有限 公司);旋转蒸发器RE-2000(上海亚荣生化仪器厂); U2800 型紫外可见分光光度计(日本,HITACHI公司); 自动部分收集器(BSZ-40-LCD);HWS26 型微电脑电 热恒温槽(上海一恒科技有限公司,上海一恒科学仪器 有限公司);Spectrum 752 p 紫外可见分光光度计(上海 恒平科学仪器有限公司);MSC300 超滤杯(超滤膜:5 kDa 和10 kDa)(上海摩速科学器材有限公司);LGJ-18 冷冻干燥机(北京松源华兴科技发展有限公司); QT-58A 智能紫外检测仪(上海琪特分析仪器有限公 司);QT-199FC-LCD 智能自动部分收集器(上海琪特 分析仪器有限公司)。 3. 方法 3.1. 酶解 泥螺去壳,取其软体采用组织捣碎技术捣碎,于 –20℃冷藏备用。取上述经捣碎的泥螺软体组织用胰 蛋白酶酶解,选用最佳酶解条件[5],即酶解温度 45℃, pH 8.7,料液比 1:4,酶解时间8 h,加酶量 0.48%。 经灭酶后,在转速 8500 rpm 左右,温度为4℃条件下 离心 25 min,弃去滤渣。 3.2. 酶解产物膜分离 取上述澄清液,使用超滤杯及截取分子量分别为 5 kDa 和10 kDa 的超滤膜,截取后分别获得分子量为 5~10 kDa 的酶解液,旋转蒸发,冷冻干燥获得固体粉 末。 3.3. 葡聚糖凝胶层析分离 Sephadex G-75用4℃蒸馏水溶胀 12 h,装入 2.6 cm × 100 cm 层析柱。取备用的冻干样品用3 mL 去离 子水溶解(0.1 g·mL–1)后,0.22 μm微孔滤膜过滤,上 柱。用超纯水平衡、洗脱,流速1.5 mL·min–1,每 2 min 收集 1管,即每1收集管为 3 mL的流出液,分别将 各收集管的流出液在波长280 nm处测定吸收值。收 集洗脱峰,浓缩冻干备用。 3.4. 细胞培养 选取人前列腺癌细胞 PC-3(原购自中科院上海细 胞库,由本实验室传代保存),用含10%胎牛血清的 F12 完全培养基于 37℃,5% CO2的培养箱中培养, 细胞呈单层贴壁生长,0.25%的胰蛋白酶消化,每 2~3 天传代 1次,实验时选用对数生长期细胞。 3.5. 细胞增殖抑制率的测定 采用 MTT 法检测。取对数生长期的前列腺癌 PC-3 细胞制成悬液,接种至96 孔板,每孔 200 μL, 置5% CO2,37℃培养箱中分别培养 24 h,然后分别 加入不同浓度泥螺多肽溶液,每个浓度设 3个平行孔, 同时设不加药对照组,置 5% CO2,37℃培养箱中孵 育24 h、48 h、72 h。培养结束后,加 PBS 溶液(pH 7.2) 清洗 3次,再加 MTT 继续培养 4 h,吸弃 MTT,加 二甲基亚砜每孔150 μL,置酶联免疫检测仪在 490 nm 测吸光度,计算细胞增殖抑制指数(IR)[7]。计算公式如 下: OD OD IR 100% OD OD 阴性对照组值 实验组值 阴性对照组 值凋零孔 值 3.6. 细胞凋亡的形态学分析 取处于指数生长期的 PC-3细胞,加入适量 0.25% 胰酶消化,用含 10%进口小牛血清的 1640 培养液配 成悬液,用血球细胞板计数,配成2 × 105·mL–1,取 放有盖玻片的 6孔细胞培养板,每孔加细胞悬液 3 mL,将细胞板放在37℃,含5% CO2的培养箱中分别 孵育 24 h 后取出。将每组药液分别加入各孔中,再将 细胞板放在 37℃,含5% CO2的培养箱中分别孵育 24 h后取出细胞培养板。取出载玻片,加 1滴混合荧光 染色液:100 μg·mL–1 吖啶橙(AO)和100 μg·mL–1 嗅乙 Copyright © 2012 Hanspub 20 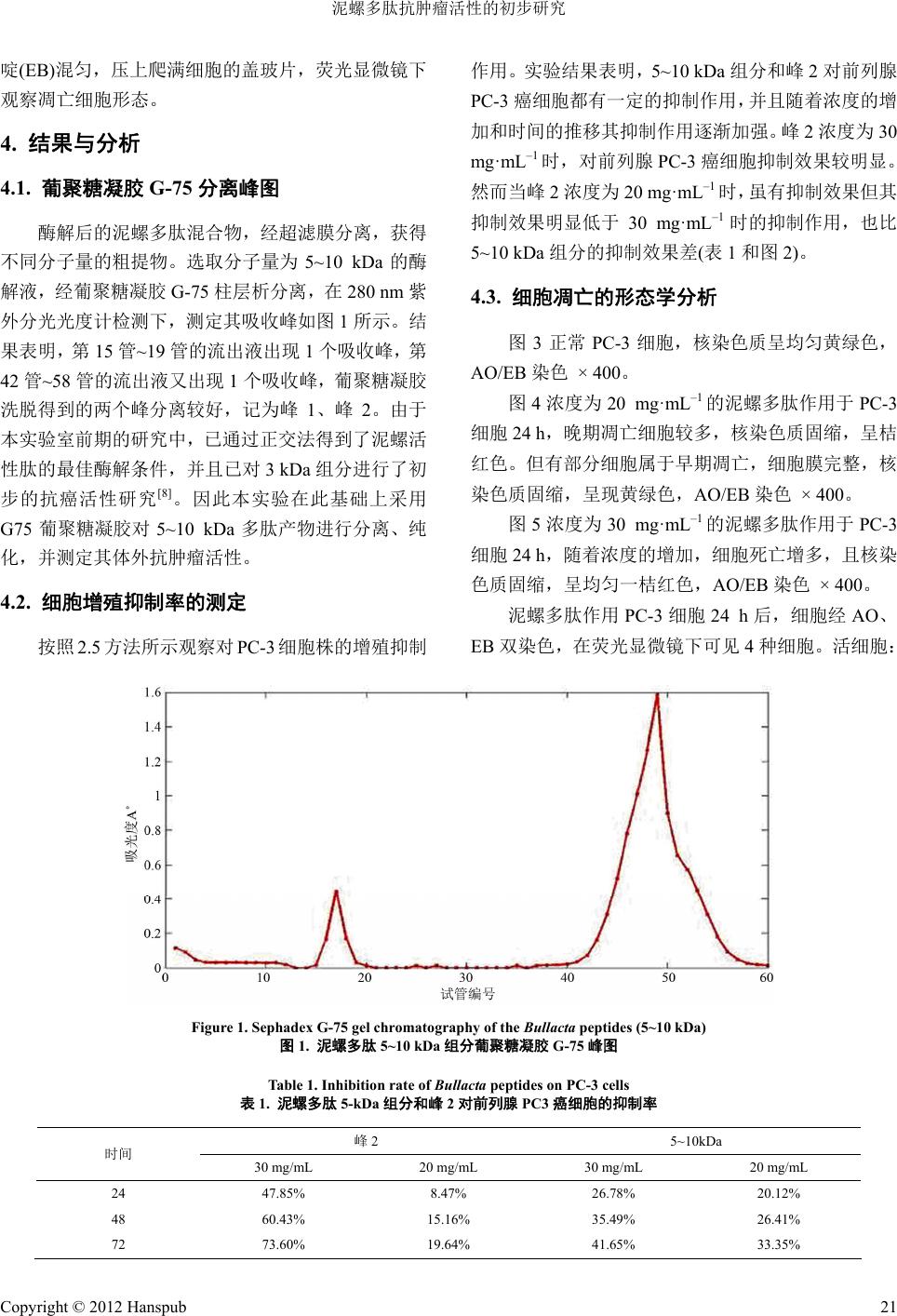 泥螺多肽抗肿瘤活性的初步研究 Copyright © 2012 Hanspub 21 啶(EB)混匀,压上爬满细胞的盖玻片,荧光显微镜下 观察凋亡细胞形态。 作用。 实验结果表明,5~10 kDa 组分和峰 2对前列腺 PC-3 癌细胞都有一定的抑制作用,并且随着浓度的增 加和时间的推移其抑制作用逐渐加强。峰2浓度为 30 mg· mL –1 时,对前列腺 PC-3 癌细胞抑制效果较明显。 然而当峰 2浓度为 20 mg·mL–1 时,虽有抑制效果但其 抑制效果明显低于 30 mg·mL–1 时的抑制作用,也比 5~10 kDa 组分的抑制效果差(表1和图2)。 4. 结果与分析 4.1. 葡聚糖凝胶 G-75 分离峰图 酶解后的泥螺多肽混合物,经超滤膜分离,获得 不同分子量的粗提物。选取分子量为 5~10 kDa的酶 解液,经葡聚糖凝胶 G-75柱层析分离,在280 nm 紫 外分光光度计检测下,测定其吸收峰如图 1所示。结 果表明,第15 管~19 管的流出液出现 1个吸收峰,第 42 管~58 管的流出液又出现 1个吸收峰,葡聚糖凝胶 洗脱得到的两个峰分离较好,记为峰1、峰 2。由于 本实验室前期的研究中,已通过正交法得到了泥螺活 性肽的最佳酶解条件,并且已对3 kDa 组分进行了初 步的抗癌活性研究[8]。因此本实验在此基础上采用 G75葡聚糖凝胶对 5~10 kDa多肽产物进行分离、纯 化,并测定其体外抗肿瘤活性。 4.3. 细胞凋亡的形态学分析 图3正常 PC-3细胞,核染色质呈均匀黄绿色, AO/EB 染色 × 400。 图4浓度为 20 mg·mL–1 的泥螺多肽作用于 PC-3 细胞 24 h,晚期凋亡细胞较多,核染色质固缩,呈桔 红色。但有部分细胞属于早期凋亡,细胞膜完整,核 染色质固缩,呈现黄绿色,AO/EB 染色 × 400。 图5浓度为 30 mg·mL–1 的泥螺多肽作用于 PC-3 细胞 24 h,随着浓度的增加,细胞死亡增多,且核染 色质固缩,呈均匀一桔红色,AO/EB染色 × 400。 4.2. 细胞增殖抑制率的测定 泥螺多肽作用PC-3 细胞 24 h后,细胞经 AO、 B双染色,在荧光显微镜下可见 4种细胞。活细胞: E 按照 2.5方法所示观察对 PC-3 细胞株的增殖抑制 Figure 1. Sephadex G-75 gel chromatography of the Bullacta peptides (5~10 kDa) 图1. 泥螺多肽 5~10 kDa组分葡聚糖凝胶 G-75 峰图 Table 1. Inhibition rate of Bullacta peptides on PC-3 cells 表1. 泥螺多肽 5-kDa 组分和峰 2对前列腺 PC3癌细胞的抑制率 峰2 5~10kDa 时间 30 mg/mL 20 mg/mL 30 mg/mL 20 mg/mL 24 47.85% 8.47% 26.78% 20.12% 48 60.43% 15.16% 35.49% 26.41% 72 73.60% 19.64% 41.65% 33.35%  泥螺多肽抗肿瘤活性的初步研究 0.00% 10.00% 20.00% 30.00% 40.00% 50.00% 60.00% 70.00% 80.00% 0 244872 T(H) IR(%) 峰2 30mg/ml 峰2 20mg/ml 5-10KDa 30mg/ml 5-10KDa 20mg/ml Figure 2. Effects of Bullacta peptides on the proliferation of PC-3 cells 图2. 泥螺多肽 5~10 kDa组分和峰 2对前列腺 PC3 癌细胞的抑制率与时间关系 Figure 3. Normal cells with EB/OB staining 图3. 正常细胞 AO/EB 双染荧光显微镜观察图 Figure 4. Low concentration of Bullacta peptides with EB/OB staining 图4. 低浓度多肽作用下 AO/EB双染荧光显微镜观察图 Figure 5. High concentration of Bullacta peptides with EB/OB staining 图5. 高浓度多肽作用下 AO/EB双染荧光显微镜观察图 核染色质呈均匀黄绿色;早期晚期凋亡细胞:细胞数 较少,细胞膜完整,但核染色质固缩,呈黄绿色荧光; 晚期凋亡细胞:核染色质固缩,呈桔红色;死亡细胞: 细胞染成均一桔红色。并且随着泥螺多肽剂量的增加, 晚期凋亡和死亡细胞逐渐增多,晚期凋亡细胞核浓聚, 被染成桔红色,而死亡细胞被染成均一的桔红色。 5. 小结 本实验结果提示,采用胰蛋白酶酶解泥螺软体组 织,并经超滤膜分离得到分子量为 5-10kDa 的粗提物, 进一步通过 G75 葡聚糖凝胶柱层析分离,所得到的多 肽产物对前列腺 PC-3细胞具有一定的抗肿瘤活性。 其抗肿瘤活性多肽的进一步分离纯化以及作用机制 还有待于深入研究。 参考文献 (References) [1] 李晔, 苏秀榕, 李太武. 泥螺抗菌肽的初步研究[J]. 台湾海 峡, 2005, 2(24): 145-149. [2] Y. Kohama, K. Suetsuna, Y. Wako, et al. Angiotensin I convertingenzyme inhibitors in fish water-soluble protein hydro- lysates prepared by bioreactor. Food Science and Technology Research, 1999, 5: 378-380. [3] K. Suetsuna, J. R. Chen. Dentification of ntihypertensive pep- tides from peptic digest of two microalgae, Chlorella vulgaris and Spirulina platensis. Marine Biotechnology, 2001, 3(4): 305- 309. [4] F. Guerard, L. Dufosse, D. L. Broise, et al. Enzymatic hydrolysis of proteins from yellow fintuna (Thunnus albacares) wastes using Alcalase. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4-6): 1051-1059. [5] 顾琳娜, 顾昊. 抗菌肽的研究进展[J]. 中草药, 2009, 40(6): 1004-1006. [6] 李晔, 苏秀榕, 李太武等. 贝类等无脊椎动物抗菌肽的研究 进展[J]. 水产科学, 2004, 23(9): 40-43. [7] 魏伟, 吴希美, 李元建. 药理实验方法学(第4版)[M]. 北京: 人民卫生出版社, 2010: 1439-1442. [8] 胡俊锋, 胡志龙, 徐律, 叶俏, 尹伊, 马剑茵. 泥螺多肽酶解 工艺的研究[J]. 健康必读杂志, 2011, 4(4): 337-339. Copyright © 2012 Hanspub 22 |