 Botanical Research 植物学研究, 2012, 1, 36-40 http://dx.doi.org/10.12677/br.2012.12006 Published Online July 2012 (http://www.hanspub.org/journal/br) Isolation of Sperm Cells of Jatropha curcas L. Yun Zhu1, Meiling Chen1, Enming He2, Huiqiao Tian1 1School of Life Science, Xiamen University, Xiamen 2Fujian Institute of Subtropical Bota n y , Xiamen Email: hqtian@xmu.edu.cn Received: May 29th, 2012; revised: Jun. 15th, 2012; accepted: Jun. 25th, 2012 Abstract: Mature pollen of Jatropha curcas L. was broken in solutions with different osmolalities, and re- leased its cytoplasmic content, including two sperms. The isolated sperms could keep viability fluorescence for 20 - 30 min and were collected to concentratio n using a micromanipulator. The state of isolated sperms in different osmolalities was analyzed. Optimal concentration of isolation solution was compared according to the isolated sperm number and its duration of keeping viability and 7.5% glucose was best for isolating the sperm cells. The sperm isolation of Jatropha curcas L. makes a basis for its reproduction engineering study and provides study material to research its sperm development. Keywords: Jatropha curcas L.; Sperm; Isolation 麻疯树精细胞分离 朱 云1,陈美灵 1,何恩铭 2,田惠桥 1 1厦门大学生命科学学院,厦门 2福建省亚热带植物研究所,厦门 Email: hqtian@xmu.edu.cn 收稿日期:2012 年5月29 日;修回日期:2012 年6月15 日;录用日期:2012 年6月25 日 摘 要:将麻疯树成熟花粉置于一定渗透剂溶液中,可使其破裂,释放出其中的一对精细胞。释放的 精细胞在 20~30 min后用 FDA 染色仍可显示具有活性的荧光。用显微操作仪将释放的精细胞收集,得 到一定数量具有活性的精细胞群体。研究了不同渗透剂浓度下释放的精细胞状态,比较了不同渗透剂 的精细胞释放率及保持精细胞活性的最适浓度,以 7.5%的葡萄糖溶液分离麻疯树精细胞的最佳浓度。 麻疯树精细胞的成功分离为其离体受精实验奠定了一定基础,也为研究麻疯树精细胞发育的分子生物 学实验提供了材料。 关键词:麻疯树;精细胞;分离 1. 引言 分离精细胞是建立高等植物离体受精实验平台 的前提之一,也是开展精细胞分子生物学研究的基础 [1]。用分离的精细胞和卵细胞体外融合的离体受精实 验已在单子叶植物玉米[2]和水稻[3]中获得植株并结 实。然而,双子叶植物的离体受精一直没有被报道。 为探索高等植物受精机制的普遍性,需要在其他植 物,尤其是双子叶植物中建立离体受精实验技术[4]。 随着精细胞分离技术的完善和分离出精细胞的植物 类型的增加,对精细胞的分子生物学研究已有报导, 主要是精细胞特异蛋白的分离[5,6]和精细胞特异基因 的分离[7,8]。最近从白花丹精细胞中克隆出了其特异基 因启动子,连接 GFP 基因后转入拟南芥中。在花粉粒 萌发时,GFP 蛋白标记的拟南芥精细胞显示了从花粉 粒进入花粉管的运动特征[9]。麻疯树(Jatropha curcas L.)是大戟科麻疯树属的一种植物,其果实中的油脂是 Copyright © 2012 Hanspub 36  麻疯树精细胞分离 一种可降解性的生物燃料,可当柴油的替代品,作为 备用未来的可持续能源引起世界的关注[10]。麻 疯 树 的 全基因组已经被日本科学家完成[11]。作为一种油料植 物,开展麻疯树的研究具有很大潜在应用价值。本文 探索麻疯树精细胞的分离和最佳条件的筛选,为开展 麻疯树离体受精实验和探索其精细胞发育机制打下 基础。 2. 材料和方法 生长在厦门大学花圃的麻疯树(Jatropha curcas L.) 通常在九月份开花。麻疯树具雌、雄同株异花的单性 花,排列成伞房状聚伞圆锥花序。雄花花萼 5枚,基 部合生,花瓣 5枚,黄绿色,合生至中部。雄花有腺 体5枚,近圆球;雄蕊 10 枚,外轮 5枚离生,内轮 5 枚花丝下部合生[12](图1(A)~(C))。选取当天开花的花 粉作为实验材料。将花药在各种渗透压的溶液中挤 破,释放出其中的花粉。很多花粉都会漂浮在溶液表 面,用滴管轻轻按压漂浮在溶液表面上的粉粒使其沉 底。渗透剂为甘露醇和葡萄糖两种,分别采用 5%, 10%,15%和20%(饱和)的浓度观察花粉爆破的结果, 分析甘露醇与葡萄糖作为渗透剂对花粉爆破的差异。 用荧光素乙二酸酯(fluorescein diacetate,FDA)染色, 测定精细胞的活性及活性荧光的持续时间。 3. 结果 将花药置于不同溶液中,用解剖针挤破花药,花 药中的花粉释放到溶液中。花粉在溶液中水合约 10 min 后,一些花粉粒爆破,花粉细胞质涌出萌发孔, 在花粉细胞质中有大量的淀粉粒,其中也包括一对体 积较大的精细胞(图1(D))。甘露醇和葡萄糖的分子量 相同,我们对比了二者分离精细胞的效果。在甘露醇 溶液中,爆破花粉释放出的精细胞具有活性荧光(图 1(E),(F)),用显微操作仪可将精细胞收集成群体后仍 具有活性荧光(图1(G),(H))。用甘露醇溶液分离的精 细胞活性荧光时间都较弱,较短,几分钟后荧光消失。 在葡萄糖溶液中,爆破花粉刚涌出的花粉细胞质中常 可见到体积较大的营养细胞核,但其很快消失。刚释 放出的花粉细胞质也具有活性荧光,但也很快消失。 在葡萄糖溶液中释放出的两个精细胞活性荧光较强 (图1(I),(J)),保持时间较长,释放出 的成 对精细 胞 在30 min还有活性荧光(图1(K),(L))。用显微操作仪 可将释放的一对精细胞收集为群体(图1(M))。 从花粉中释放出的两个精细胞保持约 30 min后, 一个精细胞先发生萎缩,失去活性荧光(图1(N),(O)), 继而另一个也失去荧光活性,但不发生萎缩,显示出 了两个精细胞的活性差异。通常从一个花粉粒中释放 出的两个精细胞之间体积差异不明显,但有时两个精 细胞之间的体积差异很明显(图1(P))。对35 对精细胞 的大小进行了统计和显著差异的计算。两组精细胞的 平均直径为 3.45 µm ± 1.25 µm和3.25 µm ± 1.25 µm。 F检验表明两个精细胞的大小并无显著差异。 花粉须在溶液中水合一段时间后才爆破。溶液的 溶质成分和浓度对花粉的爆破起关键作用。为了筛选 精细胞分离的最佳条件,设置了不同的甘露醇浓度梯 度进行花粉爆破实验。结果显示,在过低的甘露醇溶 液(5%)中,花粉爆破率可达 44.04%,但只释放出 3 对精细胞。在过高的甘露醇溶液(15%,20%)中,花粉 爆破率下降到 18%左右,释放出的精细胞数量也不 多。另外,过高浓度的甘露醇对两个精细胞造成的影 响也不同:在 15%的甘露醇溶液中释放出了3对精细 胞,而在20%的甘露醇溶液中只释放出 1对精细胞和 6个单个精细胞。而在10%甘露醇溶液中,花粉爆破 率虽然稍低(24.68%),但 释 放 出12对精细胞,精细胞 的释放率达到 10.21%(表1)。 我们也尝试了用渗透压冲击花粉释放精细胞的 效果。先将花粉在 20%饱和甘露醇溶液中水合 5 min, 然后加入等量的水进行渗透压冲击处理。在统计的 103 个花粉粒中,爆破花粉数比没有用水冲击的稍有 提高(25.24%),但仅释放出 4个精细胞(1 对加 2个单 个精细胞)。因此,用渗透压冲击处理并没有明显提高 Table 1. Effect of different mannitol concentrations on pollen breaking and sperm releasing 表1. 不同甘露醇浓度对花粉爆破和释放精细胞的影响 甘露醇 浓度(%) 花粉数 爆破花 粉数 花粉爆破 率(%) 释放出 的精细 胞数 精细胞释 放率(%) 5 109 48 44.04 6 5.50 10 235 58 24.68 24 10.21 15 115 21 18.26 6 5.22 20 137 26 18.98 8 5.84 20 + 等量水 103 26 25.24 4 3.88 Copyright © 2012 Hanspub 37 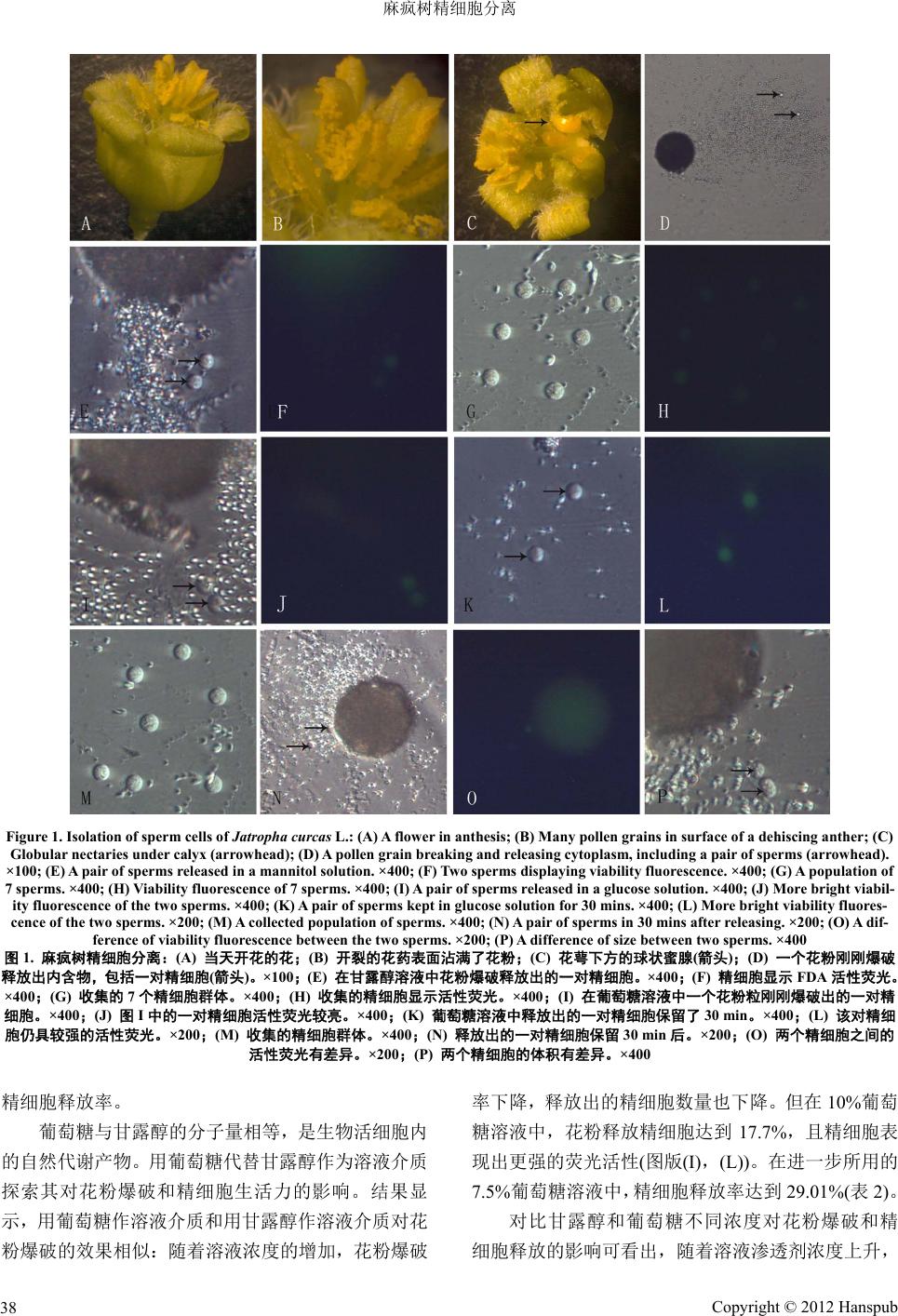 麻疯树精细胞分离 Copyright © 2012 Hanspub 38 Figure 1. Isolation of sperm cells of Jatropha curcas L.: (A) A flower in anthesis; (B) Many pollen grains in surface of a dehiscing anther; (C) Globular nec taries under calyx (arrowhead); (D) A pollen grain br eaking and releasing cytoplasm, including a pair of sperms (arrowhead). ×100; (E) A pair of sperms released in a mannitol solution. ×400; (F) Two sperms displaying viability fluorescence. ×400; (G) A population of 7 sperms. ×400; (H) Viability fluorescence of 7 sper ms. ×400; (I) A pair of sperms released in a glucose solution. ×400; (J) Mor e bright viabil- ity fluorescence of the two sperms. ×400; (K) A pair of sperms kept in glucose solution for 30 mins. ×400; (L) More bright viability fluores- cence of the two sperms. ×200; (M) A collected population of sperms. ×400; (N) A pair of sperms in 30 mins after releasing. ×200; (O) A dif- ference of viabil i t y f l u orescence between the two sperms. ×200; (P) A difference of size between two sperms. ×400 图1. 麻疯树精细胞分离:(A) 当天开花的花;(B) 开裂的花药表面沾满了花粉;(C) 花萼下方的球状蜜腺(箭头);(D) 一个花粉刚刚爆破 释放出内含物,包括一对精细胞(箭头)。×100;(E) 在甘露醇溶液中花粉爆破释放出的一对精细胞。×400;(F) 精细胞显示 FDA 活性荧光。 ×400;(G) 收集的 7个精细胞群体。×400;(H) 收集的精细胞显示活性荧光。×400;(I) 在葡萄糖溶液中一个花粉粒刚刚爆破出的一对精 细胞。×400;(J) 图I中的一对精细胞活性荧光较亮。×400;(K) 葡萄糖溶液中释放出的一对精细胞保留了 30 min。×400;(L) 该对精细 胞仍具较强的活性荧光。×200;(M) 收集的精细胞群体。×400;(N) 释放出的一对精细胞保留 30 min后。×200;(O) 两个精细胞之间的 活性荧光有差异。×200;(P) 两个精细胞的体积有差异。×400 精细胞释放率。 葡萄糖与甘露醇的分子量相等,是生物活细胞内 的自然代谢产物。用葡萄糖代替甘露醇作为溶液介质 探索其对花粉爆破和精细胞生活力的影响。结果显 示,用葡萄糖作溶液介质和用甘露醇作溶液介质对花 粉爆破的效果相似:随着溶液浓度的增加,花粉爆破 率下降,释放出的精细胞数量也下降。但在 10%葡萄 糖溶液中,花粉释放精细胞达到 17.7%,且精细胞表 现出更强的荧光活性(图版(I),(L))。在进一步所用的 7.5%葡萄糖溶液中,精细胞释放率达到 29.01%(表2)。 对比甘露醇和葡萄糖不同浓度对花粉爆破和精 细胞释放的影响可看出,随着溶液渗透剂浓度上升, 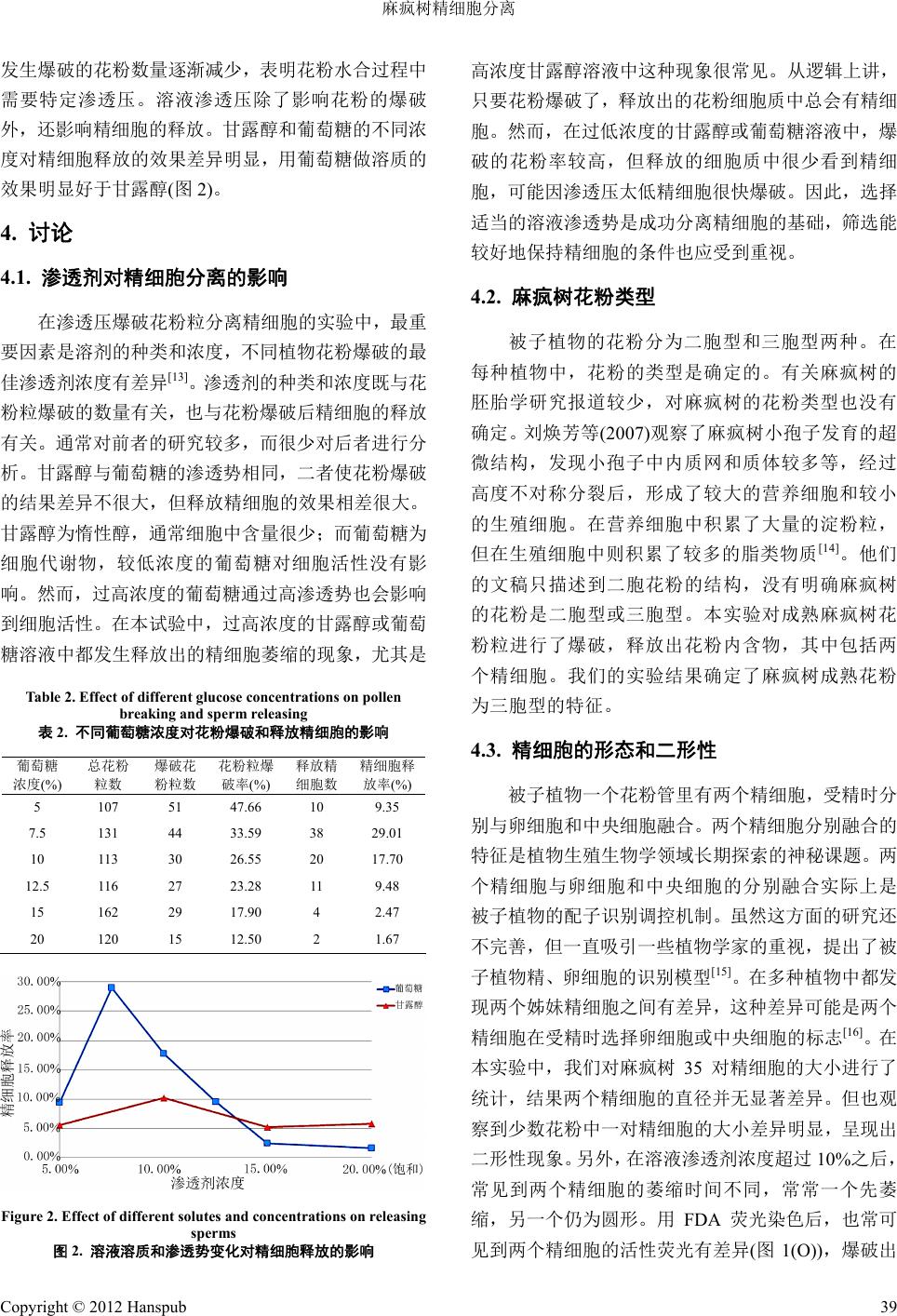 麻疯树精细胞分离 发生爆破的花粉数量逐渐减少,表明花粉水合过程中 需要特定渗透压。溶液渗透压除了影响花粉的爆破 外,还影响精细胞的释放。甘露醇和葡萄糖的不同浓 度对精细胞释放的效果差异明显,用葡萄糖做溶质的 效果明显好于甘露醇(图2)。 4. 讨论 4.1. 渗透剂对精细胞分离的影响 在渗透压爆破花粉粒分离精细胞的实验中,最重 要因素是溶剂的种类和浓度,不同植物花粉爆破的最 佳渗透剂浓度有差异[13]。渗透剂的种类和浓度既与花 粉粒爆破的数量有关,也与花粉爆破后精细胞的释放 有关。通常对前者的研究较多,而很少对后者进行分 析。甘露醇与葡萄糖的渗透势相同,二者使花粉爆破 的结果差异不很大,但释放精细胞的效果相差很大。 甘露醇为惰性醇,通常细胞中含量很少;而葡萄糖为 细胞代谢物,较低浓度的葡萄糖对细胞活性没有影 响。然而,过高浓度的葡萄糖通过高渗透势也会影响 到细胞活性。在本试验中,过高浓度的甘露醇或葡萄 糖溶液中都发生释放出的精细胞萎缩的现象,尤其是 Table 2. Effect of different glucose concentrations o n pollen breaking a n d s perm releasing 表2. 不同葡萄糖浓度对花粉爆破和释放精细胞的影响 葡萄糖 浓度(%) 总花粉 粒数 爆破花 粉粒数 花粉粒爆 破率(%) 释放精 细胞数 精细胞释 放率(%) 5 107 51 47.66 10 9.35 7.5 131 44 33.59 38 29.01 10 113 30 26.55 20 17.70 12.5 116 27 23.28 11 9.48 15 162 29 17.90 4 2.47 20 120 15 12.50 2 1.67 Figure 2. Effect of different solutes and concentrations on releasing sperms 图2. 溶液溶质和渗透势变化对精细胞释放的影响 高浓度甘露醇溶液中这种现象很常见。从逻辑上讲, 只要花粉爆破了,释放出的花粉细胞质中总会有精细 胞。然而,在过低浓度的甘露醇或葡萄糖溶液中,爆 破的花粉率较高,但释放的细胞质中很少看到精细 胞,可能因渗透压太低精细胞很快爆破。因此,选择 适当的溶液渗透势是成功分离精细胞的基础,筛选能 较好地保持精细胞的条件也应受到重视。 4.2. 麻疯树花粉类型 被子植物的花粉分为二胞型和三胞型两种。在 每种植物中,花粉的类型是确定的。有关麻疯树的 胚胎学研究报道较少,对麻疯树的花粉类型也没有 确定。刘焕芳等(2007)观察了麻疯树小孢子发育的超 微结构,发现小孢子中内质网和质体较多等,经过 高度不对称分裂后,形成了较大的营养细胞和较小 的生殖细胞。在营养细胞中积累了大量的淀粉粒, 但在生殖细胞中则积累了较多的脂类物质[14]。他们 的文稿只描述到二胞花粉的结构,没有明确麻疯树 的花粉是二胞型或三胞型。本实验对成熟麻疯树花 粉粒进行了爆破,释放出花粉内含物,其中包括两 个精细胞。我们的实验结果确定了麻疯树成熟花粉 为三胞型的特征。 4.3. 精细胞的形态和二形性 被子植物一个花粉管里有两个精细胞,受精时分 别与卵细胞和中央细胞融合。两个精细胞分别融合的 特征是植物生殖生物学领域长期探索的神秘课题。两 个精细胞与卵细胞和中央细胞的分别融合实际上是 被子植物的配子识别调控机制。虽然这方面的研究还 不完善,但一直吸引一些植物学家的重视,提出了被 子植物精、卵细胞的识别模型[15]。在多种植物中都发 现两个姊妹精细胞之间有差异,这种差异可能是两个 精细胞在受精时选择卵细胞或中央细胞的标志[16]。在 本实验中,我们对麻疯树 35 对精细胞的大小进行了 统计,结果两个精细胞的直径并无显著差异。但也观 察到少数花粉中一对精细胞的大小差异明显,呈现出 二形性现象。另外,在溶液渗透剂浓度超过 10%之后, 常见到两个精细胞的萎缩时间不同,常常一个先萎 缩,另一个仍为圆形。用 FDA 荧光染色后,也常可 见到两个精细胞的活性荧光有差异(图1(O)),爆破出 Copyright © 2012 Hanspub 39  麻疯树精细胞分离 Copyright © 2012 Hanspub 40 来后与花粉粒距离较近的精细胞活性较高。因此,麻 疯树精细胞的二形性不是呈现在两个精细胞的体积 大小差异,而主要是在两个精细胞的活力方面。 5. 致谢 感谢公益性行业(农业)科研专项经费(200903016) 和国家自然科学基金(31170289)资助。 参考文献 (References) [1] 田惠桥. 高等植物离体受精研究进展[J]. 物生理与分子生物 学学报, 2003, 29(1): 3-10. [2] E. Kranz, H. Lörz. In vitro fertilization with isolated, single gametes results in zygotic embryogenesis and fertile maize plants. Plant Cell, 1993, 5: 739-746. [3] T. Uchiumi, I. Uemura, T. Okamoto, et al. Establishm ent of an i n vitro fertilization system in rice (Oryza sativa L.). Planta, 2007, 226(3): 581-586. [4] Y. Y. Wang, A. Kuang, S. D. Russell, et al. In vitro fertilization as a tool for investigating sexual reproduction of angiosperms. Sexual Plant Reproduction , 2006, 19(3): 103-115. [5] D. Southworth, S. Kwiatkowski. Arabinogalactan proteins at the cell surface of Brassica sperm and Lilium sperm and generative cells. Sex Plant Reproduction, 1996, 9(5): 269-272. [6] H. P. Xu, T. H. Tsao. Detection and immunolocalization of gly- coproteins of the plasma membrane of maize sperm cells. Proto- plasma, 1997, 19 8(3-4): 125-129. [7] I. Tanaka. Differentiation of generative and vegetative cells in angiosperm pollen. Sexual Plant Reproduction, 1997, 10(1): 1-7 [8] C. Miao, X. P. Gou, L. Q. Lan, et al. Molecular cloning and expression of RSSG58 gene in rice sperm cells. Acta Bot Sin, 2003, 45(2): 234-241. [9] L. L. Ge, X. P. Gou, T. Yuan, et al. Migration of sperm cells during pollen tube elongation in Arabidopsis thaliana: Behavior during transport, maturation and upon dissociation of male unit associations. Planta, 2011, 233(2): 325-332. [10] P. Mukherjee, A. Varshney, T. S. Johnson, et al. Jatropha curcas: A review on biotechnological status and challenges. Plant Bio- tech Reports, 2011, 5(3): 197-215. [11] S. Sato, H. Hirakawa, S. Isobe, et al. Sequence analysis of the genome of an oil-bearing tree, Jatropha curcas L. DNA Re- search, 2011, 18(1): 65-76. [12] 王秀荣, 丁贵杰, 李平等. 麻疯树花的形态和解剖结构[J]. 林业科学, 2011, 9: 57-61. [13] 莫永胜, 杨弘远. 紫菜苔精细胞的大量分离和生活力保存[J]. 植物学报, 1991, 33: 649-657. [14] 刘焕芳, 廖景平, 吴国江. 麻疯树小孢子发育的超微结构研 究[J]. 亚热带植物学报, 2007, 2: 107-114. [15] J. E. Faure. Double fertilization in flowering plants: Origin, mechanisms and new information from in vitro fertilization. In: M. Cresti, et al., Eds., Fertilization in Higher Plants, Molecular and Cytological Aspects. Berlin: Springer-Verlag, 1999: 79-89. [16] 胡适宜, 田惠桥. 雄性生殖单位的结构与功能[J]. 被子植物 受精生物学, 北京: 科学出版社, 2002: 59-77. |