 Botanical Research 植物学研究, 2013, 2, 24-33 http://dx.doi.org/10.12677/br.2013.21005 Published Online January 2013 (http://www.hanspub.org/journal/br.html) Starch Biosynthesis and the Key Enzymes of Root and Tuber Plants* Shanshan Zhao1, Jun Yang1,2, We nzhi Zhou1, Peng Zhang1,2# 1National Key Laboratory of Plant Molecular Genetics, Institute of Plant Physiology & Ecology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 2Shanghai Chenshan Botanical Garden, Shanghai Chenshan Plant Science Research Center, Chinese Academy of Sciences, Shanghai Email: #zhangpeng@sibs.ac.cn Received: Oct. 8th, 2012; revised: Oct. 19th, 2012; accepted: Oct. 29th, 2012 Abstract: The tuber and root crops are rich in starch in their storage organs and provide important raw mate- rials not only for food and processed food, but also for modified starches and bioenergy. Starch is composed of two types of molecules, amylose and amylopectin. It can only be produced through biosynthetic pathway, a process that involves multiple enzymes of conserved functions in many crops, such as ADP-glucose phos- phorylase, starch synthases, starch branching enzymes and starch debranching enzymes. Here we review re- cent progresses in biological functions and mechanisms of these key enzymes in starch biosynthesis, includ- ing new identified enzymes such as starch phosphorylase and D-enzyme. Their features in amylose and amy- lopectin biosynthesis of tuber and root crops were also explored. It not only provides important information for identification and functional analysis of key enzymes in starch biosynthesis but also bridges the gap be- tween starch structure and property of tuber and root crops. Keywords: Tuber and Root Crops; Starch Biosynthesis; Amylose; Amylopectin; Key Enzyme 薯类植物中的淀粉生物合成及关键酶* 赵姗姗 1,杨 俊1,2,周文智 1,张 鹏1,2# 1中国科学院上海生命科学研究院,植物生理生态研究所,植物分子遗传国家重点实验室,上海 2中国科学院上海辰山植物科学研究中心,上海辰山植物园,上海 Email: #zhangpeng@sibs.ac.cn 收稿日期:2012 年10 月8日;修回日期:2012 年10 月19 日;录用日期:2012 年10月29 日 摘 要:薯类作物富含淀粉,是我国重要的粮食和食品加工原料,也是变性淀粉和生物质能源的优势 原材料。淀粉包含直链淀粉和支链淀粉两种组分,生物合成是其唯一的来源。各类作物中淀粉生物合 成由多种功能保守的关键酶类相互协调、共同作用来完成。根据其功能,这些酶分为 ADP 葡萄糖焦 磷酸化酶、淀粉合成酶、淀粉分支酶、淀粉去分支酶等。本文综述了近年来这些关键酶在生物学功能 及作用机制上的新进展,分析了淀粉合成过程中可能包含的新酶种类如淀粉磷酸化酶、D-酶等的功能, 并总结了这些酶类在薯类作物直链淀粉和支链淀粉合成中的功能特点。这为开展薯类作物中淀粉合成 酶的鉴别和功能研究,以及建立薯类淀粉结构与性质的关联性提供了重要的参考。 关键词:薯类作物;淀粉生物合成;直链淀粉;支链淀粉;关键酶 *资助信息:本研究由国家重点 基 础研究发 展计 划 项目(2010CB126605)、国家高技术研究发展计划 项目(2011AA100607、2012AA101204)、 国家木薯产业技术体系项目(nycytx-17)、上海市绿化和市容管理局专项(G102410)共同资助。 #通讯作者。 Copyright © 2013 Hanspub 24  薯类植物中的淀粉生物合成及关键酶 Copyright © 2013 Hanspub 25 1. 引言 ADP 葡萄糖焦磷酸化酶(AGPase, EC 2.4.1.21)催化的: Glucose-1-P + ATPADP-glucose + PPi 淀粉是在一些绿色细菌和高等植物的质体中形 成的一种不溶于水的多糖物质,由单一性的葡萄糖残 基组成。淀粉粒呈半晶体颗粒状结构,由直链淀粉和 支链淀粉两种组分组成。在自然界中,直链淀粉一般 占20%~30%,是由 α-1,4-糖苷键相连的葡萄糖残基 形成的线性分子;支链淀粉除含 α-1,4-糖苷键外, 还以 α-1,6-糖苷键连接分支。淀粉粒的合成是多种 酶协同作用的结果。不同植物淀粉生物合成所涉及的 酶种类大致相同,并且具有种间序列保守性,但不同 植物的合成过程也都有自己的特点。 AGPase 是由两个大亚基(AGPase large subunit, AGP-L)和两个小亚基(AGPase small subunit, AGP-S) 组成的异源四聚体,它会受到多种因子调控。其变构 作用受到甘油酸-3-磷酸(3-PGA) 激活和磷酸盐的抑制 [1];此 外,AGPase 也会受转录后水平调控。在两个小 亚基上的半胱氨酸 Cys82 之间以双硫键相连,使其氧 化还原势受到硫氧环蛋白的调控。当双硫键处于还原 态时,两个小亚基因双硫键断裂而为单体状态,AGPase 酶和激活因子 3-PGA 或底物的亲和性都增高,而与抑 制因子 Pi 的亲和性降低,酶呈激活状态,活性增强; 反之,当双硫键处于氧化态时,酶活性减弱[2]。马 铃 薯 块茎中 AGPase 的氧化还原态也可由一些糖类(如葡萄 糖、蔗糖等)激活,这是分别通过己糖激酶(Hexo- kinase)[3]和蔗糖非发酵型相关激酶(Sucrose nonfer- menting-related kinase, SNF-related kinase)途径[4]来实 现的。 AGPase 也是薯类淀粉合成的关键酶和限速酶。 在马铃薯中通过反义抑制下调 AGPase 的表达后[5], 转基因植株块茎中的糖含量增高,淀粉含量比野生型 减少 4%~35%。这些植株淀粉的晶体结构特征并无明 显变化,但直链淀粉的含量却显著降低,短链支链淀 粉积累,淀粉粒变小[6]。在马铃薯块茎中利用 patatin 启动子驱动表达大肠杆菌(Escherichia coli)AGPase 的 突变基因 glgC-16 后[7],发现转基因植株的淀粉含量 比野生型对照增加了 35%。在木薯储藏根中过量表达 定点突变的 glgC-16(G336 D)后,也发现淀粉的总含量 明显增高[8]。这些报道都证明了 AGPase 对薯类淀粉 合成具有非常重要的作用。除此以外,在薯类作物中 还发现 AGPase 对其它参与淀粉合成的酶以及储藏根 (块茎)的发育也有重要的调控功能。马铃薯块茎中 AGPase酶表达量的下调使得GBSSI的表达量增高[6]; 而甘薯中 SBEI 酶的表达模式与 AGPase 大亚基的表 达模式呈紧密正相关[9]。在 AGPase 表达量下调的马 铃薯中[5],还发现块茎的形成也受到了影响,每个植 株甚至每个茎上的块茎数目都比野生型明显增多,有 的块茎还出现了干瘪的表型。将甘薯叶片外植体置于 不同浓度 3 N O 中培养后,发现当 3 N O的浓度大于10 mM 时,储藏根的形成受到严重影响,淀粉含量减少, 同时 AGPase 的表达也受到严重抑制,但是叶片中的 人类利用淀粉的历史由来已久,淀粉不仅为植物 的生长和发育提供能量,也是人类赖以生存的重要食 物来源和工业原材料。当前广泛应用的淀粉中,一部 分来源于玉米(Zea mays)、小 麦 (Triticum aestivum)、水 稻(Oryza sativa)等谷类作物的胚乳,还有相当一部分 来源于薯类植物的贮藏器官,如马铃薯(Solanum tu- berosum)块茎、木薯(Manihot esculenta Cran t z)和甘薯 (Ipomoea batatas)的储藏根等(图1)。近年来由于能源 日渐枯竭,而我国的粮食供应又一直紧张,使得利用 这些非粮薯类开展生物质能源生产意义更为突出。本 文对近年来薯类淀粉合成中关键酶的功能研究进展 及面临的主要问题进行了探讨。 2. 参与薯块发育调控的淀粉合成限速酶 ——ADP 葡萄糖焦磷酸化酶 (ADP-Glucose Pyrophosphorylase, AGPase) 腺苷二磷酸葡萄糖(ADPG)为各类农作物中直链 淀粉和支链淀粉生物合成的直接底物,其形成是由 马铃薯 木薯甘薯 25 μm25 μm25 m μ Figure 1. Morphology of starch granules from potato, cassava and sweetpotato 图1. 薯类作物(马铃薯、木薯和甘薯)贮藏器官富集的淀粉粒形态  薯类植物中的淀粉生物合成及关键酶 淀粉含量和干物重没有变化[10]。因此 推测,在 甘薯储 藏根发育过程中,可能存在一条由 3 N O介导的信号通 路通过调节 AGPase 表达来调控淀粉的合成,并伴随 细胞增殖过程,共同促进储藏根的形成。由于 AGPase 是淀粉合成的限速酶,细胞中可以通过对 AGPase 酶 活性的调节来实现对淀粉合成代谢途径的调控,调节 碳流分配。 谷物类胚乳中存在胞质型和质体型两种 AGPase, 并且胞质型占细胞总活性的65%~95%,而马铃薯生 长的块茎中质体型 AGPase活性占97%以上[11,12]。说 明薯类 AGPase 在淀粉合成与调控上有着与谷物类胚 乳不同的机制,有待深入研究。 3. 薯块中参与直链淀粉合成的 GBSS (Granule Bound Starch Synthase) 根据与淀粉粒的结合状态,淀粉合成酶分为两大 类:颗粒结合型淀粉合成酶(Granule bound starch synthase, GBSS)和可溶性的淀粉合成酶(Soluble starch synthase, SSS)。SSS 或是溶于细胞质基质,或是呈半 溶解半偶联于淀粉粒的状态,它们参与支链淀粉的合 成。而 GBSS与淀粉粒结合紧密,它负责直链淀粉的 合成。在无特定说明的情况下,GBSS 一般指 GBSSI。 除了 GBSSI 以外,还有其它的 GBSS 同工酶。例如, 木薯叶片中 GBSSII 负责直链淀粉合成[13],是储藏根 中GBSSI 的同工酶。现在倾向于认为:只有那些与直 链淀粉合成有关的,几乎只和淀粉粒紧密结合的淀粉 合酶才能称之为 GBSS[14]。如小麦的 GBSSII 能够与 淀粉粒紧密结合,主要负责一些非贮藏组织中的直链 淀粉合成,可归为胚乳中 GBSSI 的同工酶。而甘薯、 马铃薯中的 SSII 并不负责直链淀粉的合成,虽然可以 部分结合淀粉粒,但倾向于将其划分为可溶性淀粉合 成酶类。在马铃薯[15]和其他作物如玉米[16]、小麦[17] 等的 GBSSI 缺陷型的突变体和被干扰抑制后的转基 因植株中,都表现出了直链淀粉严重缺乏或者有所降 低的性状。GBSS 能够在支链淀粉形成的半晶体区域 [18]有序地将葡萄糖残基从 ADPG 中转移至相应的葡 聚糖底物上,生成葡萄糖长链,然而在薯类作物和其 它作物中也都有证据表明 GBSSI 的功能并不局限于 直链淀粉的合成。在莱氏衣藻(Chlamydomonas rein- hardtii) sta2(编码 GBSSI)突变体中,除了缺乏直链淀 粉之外,支链淀粉的链长也受到了影响,说明 GBSSI 也参与到了支链淀粉的合成中[19] 。随后,又发现 GBSSI 也负责马铃薯[20]和水稻[21]支链淀粉中超长链 (Extra long chains,ELC)的合成。关于 GBSSI 的特性 还没有完全了解,因为目前还难以从淀粉粒中分离到 保留全部生物活性的 GBSSI 酶。 关于 GBSSI 如何合成直链淀粉目前有两种观点。 马铃薯和拟南芥中,GBSSI 能够以麦芽低聚糖(Malto- oligosaccharide, MOS)作为引物合成直链淀粉[22,23],另 外,将马铃薯 GBSSI 在体外表达后,发现其对MOS 有很高的亲和性,而当体系中加入支链淀粉后,这种 反应活性明显得到提升[24],说明支链淀粉在直链淀粉 合成中发挥了重要作用;而另外一种观点是建立在莱 氏衣藻淀粉粒研究的基础上,脉冲示踪技术研究发现 直链淀粉是从支链淀粉上合成的[25],因此在莱氏衣藻 中支链淀粉是直链淀粉合成的直接引物,直链淀粉是 从支链淀粉的分支延伸后再从其上被切除而形成的, 目前还不清楚哪种酶来切除新形成的长链。这两种观 点的差异主要在于直链淀粉启动合成所需的引物和 支链淀粉在合成过程中的作用。很可能自然界中两种 直链淀粉的合成模式都存在,并具有物种或组织特异 性(图2)。 GBSSI 合成的直链淀粉一般发生在淀粉粒的中 心区域[18,26]。在反义抑制 GBSSI 表达的马铃薯转基因 株系中,碘染后的淀粉粒在脐点附近仍然显现出一定 区域的蓝色,这个区域的大小与 GBSSI 的表达量成正 比关系,而且在质体逐渐发育的过程中,随淀粉粒增 大而成比例增长。但这个区域受到支链淀粉基质空间 的限制,因而淀粉粒中直链淀粉的最高含量可能决定 于所利用的最大基质空间,这可能也是自然界中的直 链淀粉含量一般不会超过 30%的原因。 严重缺乏直链淀粉的淀粉粒在表面结构上都表 现正常,说明淀粉粒的形成并没有受到很大影响,目 前也没发现完全缺失支链淀粉的突变体。因此支链淀 粉对淀粉粒结构的形成才是必需的。那么直链淀粉合 成的意义何在?研究表明水稻直链淀粉有利于淀粉 粒结构的稳定[27],木薯中直链淀粉的存在有利于淀粉 粒三维结构的维持[28]。直链淀粉的合成可能增加了淀 粉的密度,提高了碳的存储效率[29]。这些推论还有待 进一步实验证据的支持。直链淀粉的合成与植物生长 发育是否有着密切的关系、GBSS 蛋白功能保守性的 意义何在还需要深入研究。 Copyright © 2013 Hanspub 26 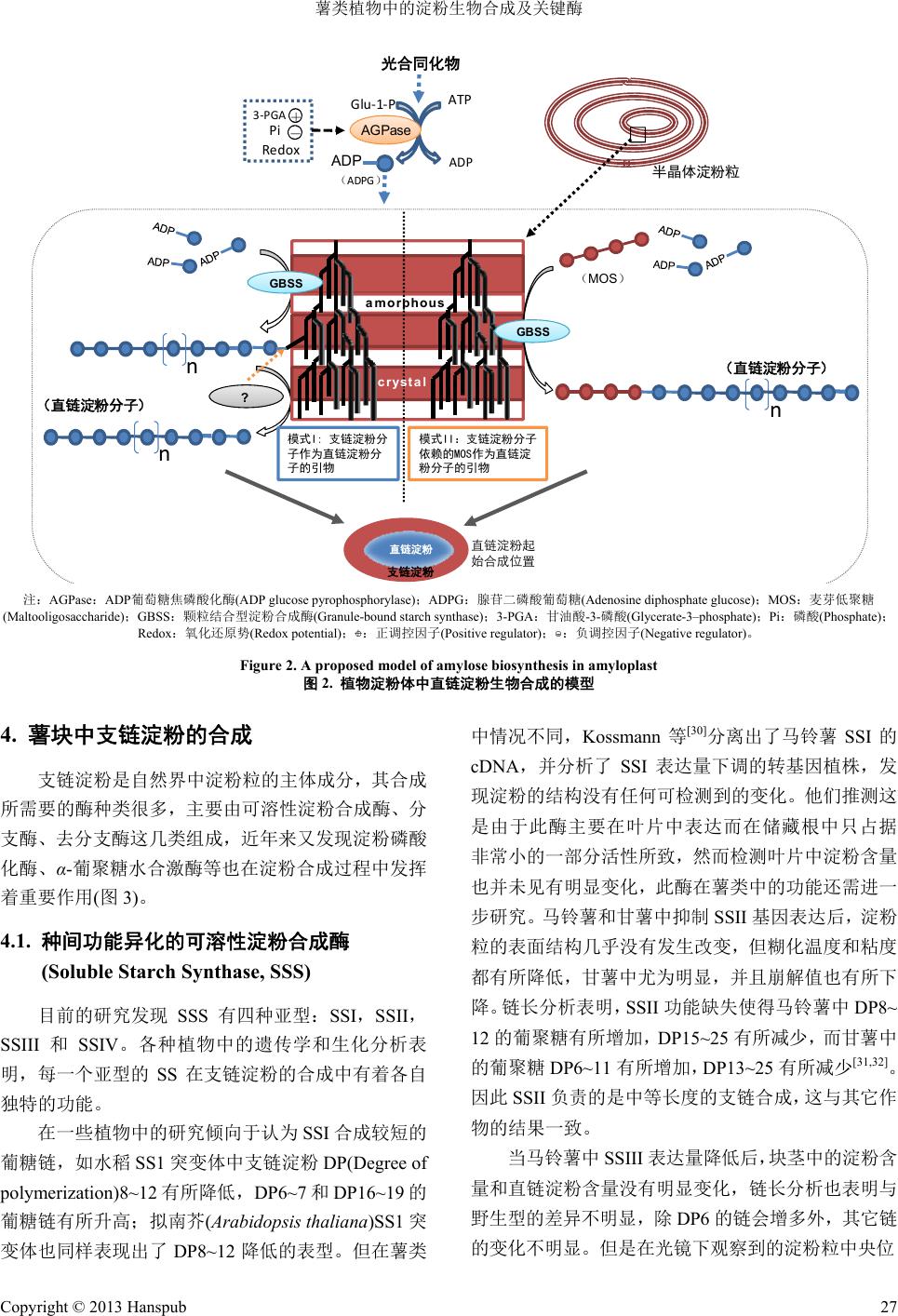 薯类植物中的淀粉生物合成及关键酶 Copyright © 2013 Hanspub 27 AG Pase ATP Glu-1-P ADP (ADPG) ADP (MOS) n n ? n (直链淀粉分子) 直链淀粉起 始合成位置 直链淀粉 支链淀粉 半晶体淀粉粒 (直链淀粉分子) 3-PGA + - Pi Redox 光合同化物 模式I: 支链淀粉分 子作为直链淀粉分 子的引物 模式II:支链淀粉分子 依赖的MOS作为直链淀 粉分子的引物 GB SS GBSS crystal amorphous 注:AGPase:ADP葡萄糖焦磷酸化酶(ADP glucose pyrophosphorylase);ADPG:腺苷二磷酸葡萄糖(Adenosine diphosphate glucose);MOS:麦芽低聚糖 (Maltooligosacch ari de);GBSS:颗粒结合型淀粉合成酶(Granule-bound starch synthase);3-PGA:甘油酸-3-磷酸(Glycerate-3–phosphate);Pi:磷酸(Phosphate); Redox:氧化还原势(Redox potential);○+:正调控因子(Positive regulator);○-:负调控因子(Negative regulator)。 Figure 2. A proposed model of amylose biosynthesis in amyloplast 图2. 植物淀粉体中直链淀粉生物合成的模型 4. 薯块中支链淀粉的合成 中情况不同,Kossmann等[30]分离出了马铃薯 SSI 的 cDNA,并分析了 SSI 表达量下调的转基因植株,发 现淀粉的结构没有任何可检测到的变化。他们推测这 是由于此酶主要在叶片中表达而在储藏根中只占据 非常小的一部分活性所致,然而检测叶片中淀粉含量 也并未见有明显变化,此酶在薯类中的功能还需进一 步研究。马铃薯和甘薯中抑制 SSII 基因表达后,淀粉 粒的表面结构几乎没有发生改变,但糊化温度和粘度 都有所降低,甘薯中尤为明显,并且崩解值也有所下 降。链长分析表明,SSII 功能缺失使得马铃薯中 DP8~ 12 的葡聚糖有所增加,DP15~25有所减少,而甘薯中 的葡聚糖 DP6~11 有所增加,DP13~25 有所减少[31,32]。 因此 SSII 负责的是中等长度的支链合成,这与其它作 物的结果一致。 支链淀粉是自然界中淀粉粒的主体成分,其合成 所需要的酶种类很多,主要由可溶性淀粉合成酶、分 支酶、去分支酶这几类组成,近年来又发现淀粉磷酸 化酶、α-葡聚糖水合激酶等也在淀粉合成过程中发挥 着重要作用(图3)。 4.1. 种间功能异化的可溶性淀粉合成酶 (Soluble Starch Synthase, SSS) 目前的研究发现 SSS 有四种亚型:SSI,SSII, SSIII 和SSIV 。各种植物中的遗传学和生化分析表 明,每一个亚型的 SS在支链淀粉的合成中有着各自 独特的功能。 在一些植物中的研究倾向于认为SSI合成较短的 葡糖链,如水稻 SS1突变体中支链淀粉DP(Degree of polymerization)8~12 有所降低,DP6~7 和DP16~19 的 葡糖链有所升高;拟南芥(Arabidopsis thaliana)SS1 突 变体也同样表现出了DP8~12 降低的表型。但在薯类 当马铃薯中 SSIII 表达量降低后,块茎中的淀粉含 量和直链淀粉含量没有明显变化,链长分析也表明与 野生型的差异不明显,除DP6 的链会增多外,其它链 的变化不明显。但是在光镜下观察到的淀粉粒中央位 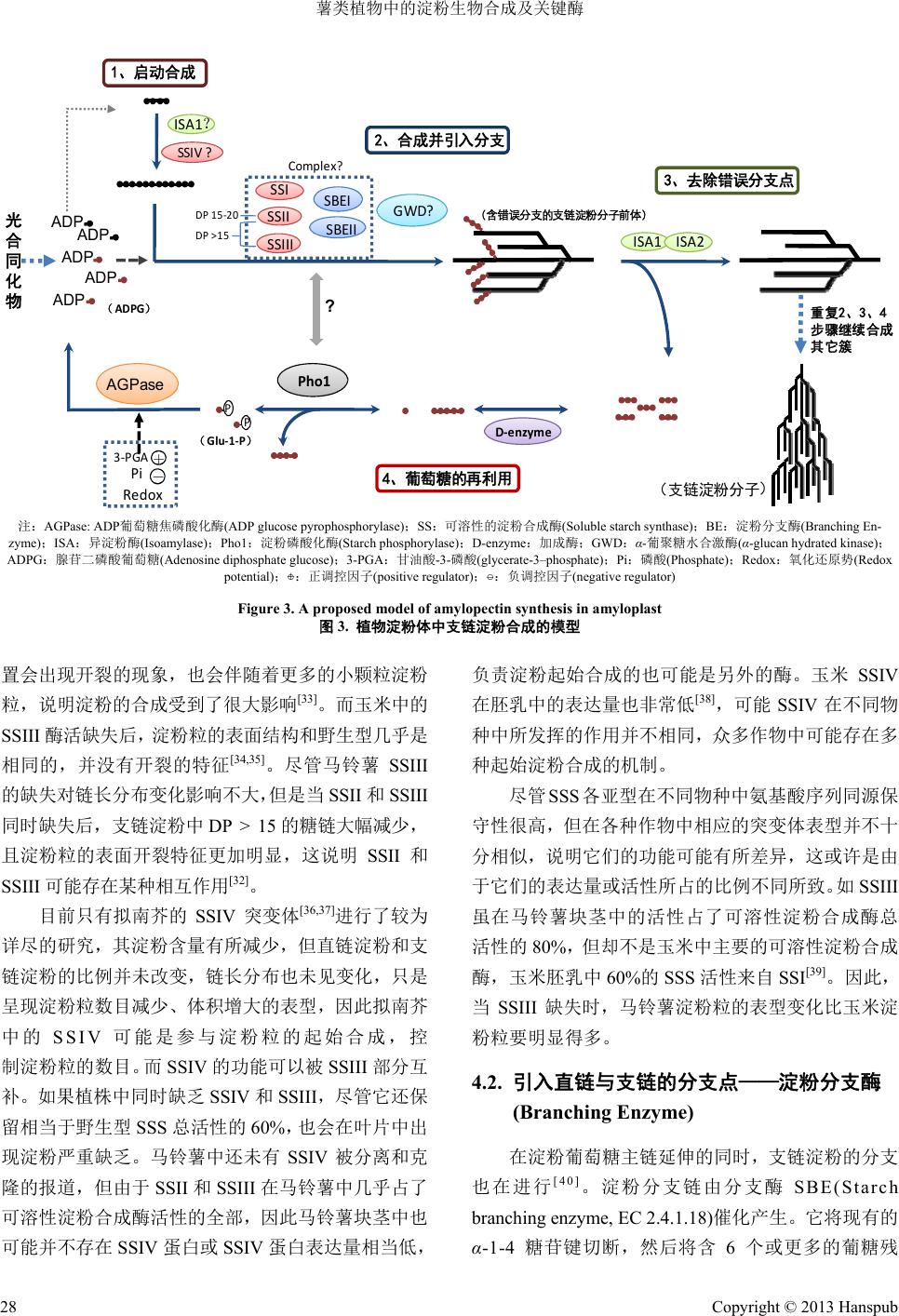 薯类植物中的淀粉生物合成及关键酶 SBEI SBEII SSIII SSII SSI ISA2 Pho1 D-enzyme (Glu-1-P) AGPase ADP (支链淀粉分子) (ADPG) DP 15-20 Complex ? SSIV ? ISA1? P P (含错误分支的支链淀粉分子前体) 4、葡萄糖的再利用 ADP ? 3、去除错误分支点 重复2、3、4 步骤继续合成 其它簇 3-PGA+ - Pi Re d o x DP >15 GWD? 光 合 同 化 物 1、启动合成 2、合成并引入分支 ADP ADP ADP ISA1 注:AGPase: ADP葡萄糖焦磷酸化酶(ADP glucose pyrophosphorylase);SS:可溶性的淀粉合成酶(Soluble starch synthase);BE:淀粉分支酶(Branching En- zyme);ISA:异淀粉酶(Isoamylase);Pho1:淀粉磷酸化酶(Starch phosphorylase);D-enzyme:加成酶;GWD:α-葡聚糖水合激酶(α-glucan hydrated kinase); ADPG:腺苷二磷酸葡萄糖(Adenosine diphosphate glucose);3-PGA:甘油酸-3-磷酸(glycerate-3–phosphate);Pi:磷 酸(Phosphat e) ;Redox:氧化还原势(Redox potential);○+:正调控因子(positive regulator);○–:负调控因子(negative regulator) Figure 3. A proposed model of amylopectin synthesis in amyloplast 图3. 植物淀粉体中支链淀粉合成的模型 置会出现开裂的现象,也会伴随着更多的小颗粒淀粉 粒,说明淀粉的合成受到了很大影响[33]。而玉米中的 SSIII 酶活缺失后,淀粉粒的表面结构和野生型几乎是 相同的,并没有开裂的特征[34,35]。尽管马铃薯 SSIII 的缺失对链长分布变化影响不大,但是当 SSII 和SSIII 同时缺失后,支链淀粉中 DP > 15的糖链大幅减少, 且淀粉粒的表面开裂特征更加明显,这说明 SSII 和 SSIII 可能存在某种相互作用[32]。 目前只有拟南芥的 SSIV 突变体[36,37]进行了较为 详尽的研究,其淀粉含量有所减少,但直链淀粉和支 链淀粉的比例并未改变,链长分布也未见变化,只是 呈现淀粉粒数目减少、体积增大的表型,因此拟南芥 中的 SSIV可能是参与淀粉粒的起始合成,控 制淀粉粒的数目。而 SSIV 的功能可以被 SSIII 部分互 补。如果植株中同时缺乏 SSIV 和SSIII,尽管它还保 留相当于野生型 SSS总活性的 60%,也会在叶片中出 现淀粉严重缺乏。马铃薯中还未有SSIV 被分离和克 隆的报道,但由于 SSII和SSIII 在马铃薯中几乎占了 可溶性淀粉合成酶活性的全部,因此马铃薯块茎中也 可能并不存在 SSIV蛋白或 SSIV 蛋白表达量相当低, 负责淀粉起始合成的也可能是另外的酶。玉米SSIV 在胚乳中的表达量也非常低[38],可能 SSIV 在不同物 种中所发挥的作用并不相同,众多作物中可能存在多 种起始淀粉合成的机制。 尽管 SSS 各亚型在不同物种中氨基酸序列同源保 守性很高,但在各种作物中相应的突变体表型并不十 分相似,说明它们的功能可能有所差异,这或许是由 于它们的表达量或活性所占的比例不同所致。如 SSIII 虽在马铃薯块茎中的活性占了可溶性淀粉合成酶总 活性的 80%,但却不是玉米中主要的可溶性淀粉合成 酶,玉米胚乳中 60%的SSS 活性来自 SSI[39]。因此, 当SSIII 缺失时,马铃薯淀粉粒的表型变化比玉米淀 粉粒要明显得多。 4.2. 引入直链与支链的分支点——淀粉分支酶 (Branching Enzyme) 在淀粉葡萄糖主链延伸的同时,支链淀粉的分支 也在进行[40]。淀粉分支链由分支酶 SBE(Starch branching enzyme, EC 2.4.1.18)催化产生。它将现有的 α-1-4 糖苷键切断,然后将含6个或更多的葡糖残 Copyright © 2013 Hanspub 28  薯类植物中的淀粉生物合成及关键酶 基的糖链转移至另外的或同一葡萄糖链上的 C6 位置 上。高等植物的 SBE 基因分为两个亚型:SBEI(SBEb) 和SBEII(SBEa),这两类分支酶在支链淀粉合成中有 着独特的作用。 马铃薯 SBEII 被抑制表达后,淀粉粒结构有所改 变,支链淀粉链长增加,直链淀粉的含量上升至 38%[41];甘薯 SBEII 缺失的转基因植株也会表现出直 链淀粉升高的趋势[42]。而马铃薯 SBEI 被抑制之后直 链淀粉含量并未出现明显的上升趋势[43]。Schwall 等[44] 将马铃薯的 SBEI 和SBEII 的活性全部抑制后,直链 淀粉的含量最高可达 75%。由此可见,在支链淀粉合 成中,SBEI 和SBEII 的功能上有一定的互补关系, SBEII 能互补SBEI 的大部分功能,而 SBEI 则只能互 补SBEII 小部分的功能。这可能跟两者的底物特异性 有关。Rydberg 等[45]将马铃薯的 SBEI 和SBEII 在大 肠杆菌中表达,以链长8~200 个葡萄糖残基的线性糊 精为底物,分析比较了它们的体外活性。尽管发现 SBEI 和SBEII 催化的产物中都包括大量的 DP11-14 的糖链和小部分的 DP6-7 的糖链,但是底物亲和性分 析表明,马铃薯中的SBEI更倾向于将直链淀粉作为 底物,而 SBEII 则喜好选择支链淀粉为底物;并且发 现SBE 催化的分支结构都是在同一支链分子内 (intrachain)进行的。 在SBE 表达量降低的马铃薯块茎中,还会发现淀 粉含磷量的明显升高。对此,Jobling 等认为由于支链 淀粉的较长链中才含磷[46],而当SBE 酶表达量的降低 使得支链淀粉分子的长链增多时,自然磷含量水平会 增多。SBE 的酶活也可受磷酸化激活[45],在体外实验 体系添加磷酸盐后,马铃薯SBEI 和SBEII 的活性都 会显著升高。这种现象在小麦中也存在[47],但是其 中 的生化机制并不清楚。 木薯糖化突变体[48]中,可溶性糖含量比对照高出 100 多倍。分析后发现突变体中 SBEI和SBEII基因在 RNA 水平和蛋白水平都没有表达;AGPase 蛋白量有 所下降,其 mRNA 表达水平却没有发生改变。由于目 前已知的 SBE 突变体和表达下调的转基因植株中,都 主要表现在直链淀粉水平的升高,而非大量可溶性糖 分的出现,因此糖化表型可能与突变体中 AGPase 蛋 白量下降有关,也可能还存在其它与 SBE、AGPas e 相关的酶或者调控因子的变化未被检出,针对此突变 体的进一步研究可加深对薯类淀粉合成的理解。 4.3. 支链淀粉的结晶依赖于去分支酶 (Debranching Enzyme, DBE) 除了 SS 和SBE 之外,其它一些葡聚糖修饰酶也 会参与淀粉的生物合成。去分支酶(Debranching en- zyme, DBE, α-1, 6-葡聚糖水解酶),它的作用是清除 错误的分支点,使得支链淀粉形成易于结晶的螺旋 结构,是决定淀粉结构形成的一个关键酶。 植物中包含两种类型的 DBE :异淀粉酶 (Isoamylase, ISA, EC 3.2.1.68)和极限糊精酶(Limit dextrinase, LDA, EC 3.2.1.142,也叫普鲁兰酶)。这两 种酶的氨基酸序列和底物特异性各有不同。ISA 包括 ISA1、ISA2和ISA3。多数作物如马铃薯中,ISA1 和 ISA2 可形成一个异源多聚复合体[49]。但在水稻胚乳 中,ISA1 既可以形成同源多聚体,也可以和ISA2 形 成异源多聚体[50]。一般认为,ISA1 和ISA2 与支链淀 粉合成密切相关,而 LDA 和ISA3则主要在淀粉降解 途径中发挥作用。ISA1 的最适底物是可溶性的支链淀 粉(具有特别长的外部链)。而 LDA和ISA3 则对短外 部链的葡聚糖底物有高活性,如 β-极限糊精。马铃薯 的ISA2 没有催化活性[49],它可能通过调控 ISA1 的活 性或者稳定性间接参与去分支反应[51]。 当马铃薯 ISA1 蛋白缺失后,颗粒型的淀粉会减 少甚至消失,被水溶性的葡聚糖部分取代[52],这种现 象也存在于谷物胚乳[53]、绿藻[54]和拟南芥叶片中[51]。 马铃薯和拟南芥 ISA2 的缺失也会出现同样的效果 [51,52]。在这些ISA 缺失的植株中,出现的可溶性葡聚 糖主要是类似糖原的一种聚合物,称之为植物糖原 (Phytoglycogen)。植物糖原中短糖链(少于 10个葡糖 残基)会占很高的比例并且比支链淀粉拥有更多的分 支点。据此推测,这种分支结构会使得植物糖原不能 形成像支链淀粉一样的高度有序的结构。野生型中形 成淀粉粒而非植物糖原的累积,意味着正常情况下, 一些由 SBE 引入的分支点会通过选择性的水解而得 以去除,支链淀粉通过自组织形成淀粉粒。如果保留 有所有的分支,则成为植物糖原而累积[55,56]。 在几种作物的 ISA1 缺失突变体中,淀粉粒的数 量会增加[52,53]。Bustos 等[52]认为 ISA1 本身直接参与 淀粉粒的起始合成,控制着淀粉粒的数量;而Streb 等[57]认为拟南芥中 ISA1 缺失引起的淀粉颗粒增多很 可能是间接的。在 ISA1 缺失的情况下,大量积累的 Copyright © 2013 Hanspub 29  薯类植物中的淀粉生物合成及关键酶 可溶性葡聚糖会成为淀粉粒启动合成的引物[54]。DBE 酶活完全丧失的拟南芥四突变体(isa1isa2isa3lda)中 [57],虽然并不含有可见的淀粉颗粒,但如果将 AMY3 的活性也抑制后,淀粉粒的合成又部分恢复了。说明 由SS和SBE 形成的产物实际上是有形成淀粉粒能力 的。四突变体中植物糖原所富含的极其短的分支链(小 于6个葡萄糖残基)和小分支状的 MOS 以及麦芽糖应 该是由 α-淀粉酶和 β-淀粉酶产生的。因此认为 SS 和 SBE 所形成的分支可由 ISA1去除,而当 DBE 活性全 部丧失后,多分支的存在影响了淀粉双螺旋的形成效 率,成为降解酶类如 AMY3 等的底物,使得分支更短, 形成植物糖原,颗粒形态的结构几乎全部丧失。因此, 在拟南芥四突变体中完全丧失淀粉是由于淀粉降解 类酶对游离分支的降解,而非由于 DBE 活性引起的。 马铃薯 isa突变体是否与拟南芥中的情形相似还未可 知,而木薯和甘薯的 ISA1 基因刚刚被分离出来[58,59], 关于它们的功能还需深入研究。 4.4. 薯类淀粉合成中功能尚不明确的其它成员 近年来,淀粉磷酸化酶(Starch phosphoylase, SP, EC 2.4.1.1),又称为 α-葡聚糖磷酸化酶,在淀粉合成 中的潜在作用成了一个新的研究焦点。它可以使葡萄 糖-1-磷酸通过释放磷酸盐成为合成葡聚糖链的底物, 并且这个反应是可逆的: (1,4-α-D-glucosyl)n + G-1-P (1,4-α-D-glucosyl)n +1 + Pi 在大多数高等植物中,SP 分为两种类型,基质型 Pho1,L-型或者称为L-SP;胞质型 Pho2,H-型或者 H-SP。这两种类型在分子量大小和底物特异性上有所 不同。通常认为 SP参与到淀粉的降解过程中,而在 不同物种中的遗传学分析都得出了与此相矛盾的结 论。Sonnewald 等[60]发现马铃薯 Pho1 的缺陷型突变体 叶片中淀粉累积没有增加,拟南芥的T-DNA 插入突 变pho1 植株也发生同样的情况。而水稻 pho1 突变体 植株如果处在 30℃生长,胚乳中淀粉含量正常,但在 20℃的条件下与对照相比明显降低[61]。这些都让人对 Pho1 在淀粉降解中的作用产生疑惑。小麦 Pho1 和其 它的酶,比如SBE,存在蛋白互作[62],这暗示着Pho1 对于淀粉代谢的作用可能是间接的。而在马铃薯中, Albrecht 等[63]发现 Pho1 可能在淀粉合成中发挥作用, 因为其表达和酶活性表现出与淀粉累积过程呈明显 正相关的趋势,但 Pho1 如何参与淀粉合成并不清楚。 结合 Ball 和Morell[64]提出的“葡聚糖修剪”模型(Glucan trimming model),Takaha 等[65]认为有可能 D-酶(Dis- proportionating enzyme, DE,EC 2.4.1.25)和Pho1 酶共 同协作,实现淀粉合成中一些剩余葡聚糖的循环再利 用:在支链淀粉合成中,会由去分支酶 DBE 产生一 些短链的葡聚糖,D-酶可以将这些链延长提供给 Pho1 作为底物。而其中所释放的G-1-P 则可以被 AGPase 所利用而产生 ADPG(图3)。 关于 Pho2 的底物和生物学功能,目前仍然不是 很清楚。Steup 等[66]认为菠菜叶绿体中的 Pho2 在降解 大分支状的葡聚糖时效率更高,甚至可能直接降解淀 粉粒。但马铃薯中反义抑制Pho2 的表达,并未发现 淀粉降解有变化,而是开花和发芽数目增多,花序出 现的时间较早[67]。这些现象使得人们怀疑 Pho2 可能 并未参与到淀粉代谢途径中去。SP 的功能还需深入研 究和探讨。 除了 SP 酶外,已知在淀粉磷酸化和降解途径中 发挥重要作用的马铃薯 GWD(Glucan water dikinase, EC 2.7.9.4)也可能参与淀粉的合成[68],马铃薯淀粉相 关蛋白质组学研究发现,在块茎发育初期和成熟块茎 中,与淀粉粒结合的蛋白中除了 GWD蛋白的作用还 未完全了解外,其余均为淀粉合成酶类[69],但目前 还 没有明确的证据证明 GWD 确实参与淀粉合成。 4.5. 淀粉合成研究的新热点——支链淀粉合成 中酶的相互作用 在禾谷类作物的淀粉贮存器官中,淀粉合成相关 的各种酶包括 SS、SBE 等常以多酶复合体的形式存 在。这些引起了众多学者的关注。在小麦中发现了 SBEI 和SBEII 组成复合体,还有SSI、SSII 和SBEII[70] 组成的复合体。而在玉米中发现了 SSII、SSIII 和SBEII 复合体[71-73]。另外,AGPase、丙酮酸磷酸二激酶(Pyru- vate orthophosphate dikinase, PPDK, EC 2.7.9.1)和SP 也会出现在 SS/SBE 复合体中。SP 在复合体中的存在 恰恰说明了该酶可能参与淀粉合成。SS/SBE酶复合 体的稳定性是依赖于蛋白磷酸化的[70],体外实验证明 非特异性磷酸酶的去磷酸化可以使这种复合体解偶 联[62,70,72],在小麦中这种去磷酸化还可以使SBEII失 Copyright © 2013 Hanspub 30  薯类植物中的淀粉生物合成及关键酶 活。在体内,也有蛋白激酶和磷酸化酶负责淀粉合成 酶的磷酸化和去磷酸化[62]。 虽然发现了多种淀粉合成酶复合体,但目前仍不 清楚这些酶之间是如何相互协调,从葡聚糖底物生成 支链淀粉分子,并进一步自组装形成淀粉粒的。这些 问题可能要借助于新的分析手段来解决。蛋白质组、 免疫共沉淀等分析手段的应用对研究淀粉合成过程 中蛋白互作提供了条件。但目前还无法确定酶复合体 的形成在淀粉合成中是否是一种普遍现象,有多少种 不同类型的酶复合体也有待确定。在小麦胚乳发育过 程中,类似的复合体并没有在叶片中找到[62]。虽然在 薯类中发现有些淀粉合成酶之间的表达调控紧密联 系[6],但目前还没有淀粉合成酶复合体研究的报道, 各种复合体在薯类作物中是否普遍存在是值得关注 的,深入研究将有助于加深对薯类淀粉合成以及生物 大分子自组装的认知。 5. 展望 近年来,通过各种植物的突变体和转基因植株分 析,对参与淀粉合成的酶系特性以及淀粉合成过程有 了更深入的了解。然而当前的研究进展还不足以揭示 淀粉粒生物合成的全貌。薯类淀粉研究领域中目前只 有马铃薯研究得较为深入,在木薯、甘薯、芋头等经 济作物中,只是对淀粉合成相关酶进行了分离和初步 的功能鉴定,具体的酶促反应和特性研究较少。这主 要是由于薯类作物遗传背景复杂,传统育种中筛选到 的突变体较少,基因工程改造难度也较一般作物大, 如木薯在淀粉关键酶遗传工程改造上至今只有少数 几例成功的报道[8,28,74],这些都使得薯类淀粉合成的研 究滞后于谷类作物。但从长远来看,加强薯类作物淀 粉合成的研究对生物质能源的开发和利用有着重要 的战略意义。 薯类淀粉合成研究领域也亟需解决众多基础性 问题。一方面,对于参与淀粉合成的酶系还需要进一 步的功能阐述。单体酶如 GBSS 进行直链淀粉合成的 具体机制如何?一些多酶复合体如SS/SBE 等是否普 遍存在于所有薯类作物中?各种酶类如何相互协调 进行支链淀粉的合成?还可能有参与淀粉合成的 新型酶未被分离出来,这些都是吸引众多学者关注的 焦点。另一方面,对于淀粉粒本身的细致结构也需要 更详尽的研究。这可能需要借助新的技术手段,例如 直接从淀粉体中提取出正在合成的淀粉粒前体,离体 研究动态合成中的各种淀粉结构等。 薯类作物中的淀粉合成有其独特性。例如薯类中 AGPase不仅在淀粉合成中发挥重要作用,也与储藏 根(块茎)的发育调控息息相关,又可能是碳流代谢的 重要调控枢纽。其作用机制的阐明不仅能够为薯类作 物的储藏根发育机制打开广阔的思路,甚至可为非薯 类作物通过遗传操作形成人造淀粉贮藏器官提供了 可能性。另外,薯类作物的淀粉合成和谷类等其它作 物相比,在淀粉粒起始、直链淀粉的合成等机制上可 能存在很大差别。薯类作物中分离出的 SSS、SBE、 DBE 等基因的缺失突变体与其它作物相比又都有独 特的表型。深入研究这些问题无疑对理解薯类作物生 长发育调控机制意义重大,也将对利用基因工程开展 作物遗传改良发挥理论指导作用。 6. 致谢 感谢郑奇婕、王珊珊在本文组织和撰写方面的帮 助和建议。 参考文献 (References) [1] M. J. Emes, H. E. Neuhaus. Metabolism and transport in non- photosynthetic plastids. Journal of Experimental Botany, 1997, 48(12): 1995-2005. [2] P. Geigenberger, A. Kolbe and A. Tiessen. Redox regulation of carbon storage and partitioning in response to light and sugars. Journal of Experimental Botany, 2005, 56(416): 1469-1479. [3] A. Tiessen, J. H. M. Hendriks, M. Stitt, et al. Starch synthesis in potato tubers is regulated by post-translational redox modifi- cation of ADP-Glucose pyrophosphorylase: A novel regulatory mechanism linking starch synthesis to the sucrose supply. Plant Cell, 2002, 14(9): 2191-2213. [4] A. Tiessen, K. Prescha, A. Branscheid, et al. Evidence that SNF1-related kinase and hexokinase are involved in separate sugar-signalling pathways modulating post-translational redox activation of ADP-glucose pyrophosphorylase in potato tubers. The Plant Journal, 2003, 35(4): 490-500. [5] B. Müller-Röber, U. Sonnewald and L. Willmitzer. Inhibition of the ADP-glucose pyrophosphorylase in transgenic potatoes leads to sugar-storing tubers and influences tuber formation and ex- pression of tuber storage protein genes. EMBO Journal, 1992, 11(4): 1229-1238. [6] J. R. Lloyd, F. Springer, A. Buléon, et al. The influence of alter- ations in ADP-glucose pyrophosphorylase activities on starch structure and composition in potato tubers. Planta, 1999, 209(2): 230-238. [7] D. M. Stark, K. P. Timmerman, G. F. Barry, et al. Regulation of the amount of starch in plant tissues by ADP glucose pyro- phosphorylase. Science, 1992, 258(5080): 287-292. [8] U. Ihemere, D. Arias-Garzon, S. Lawrence, et al. Genetic modi- fication of cassava for enhanced starch production. Plant Bio- technology Journal, 2006, 4(4): 453-465. [9] T. Hamada, S. H. Kim and T. Shimada. Starch-branching enzy- me I gene (IbSBEI) from sweet potato (Ipomoea batatas); mole- Copyright © 2013 Hanspub 31  薯类植物中的淀粉生物合成及关键酶 cular cloning and expression analysis. Biotechnology Letters, 2006, 28(16): 1255-1261. [10] S. H. Kim, K. Mizuno, S. Sawada, et al. Regulation of tuber formation and ADP-glucose pyrophosphorylase (AGPase) in sweet potato (Ipomoea batatas (L.) Lam.) by nitrate. Plant Growth Regulation, 2002, 37(3): 207-213. [11] M. G. James, K. Denyer and A. M. Myers. Starch synthesis in the cereal endosperm. Current Opinion in Plant Biology, 2003, 6: 215-222. [12] A. Tiessen, A. Nerlich, B. Faix, et al. Sub-cellular analysis of starch metabolism in developing barley seeds using a non- aqueous fractionation method. Journal of Experimental Botany, 2012, 63(5): 2071-2087. [13] T. R. I. Munyikwa, S. Langeveld, S. N. I. M. Salehuzzaman, et al. Cassava starch biosynthesis: New avenues for modifying starch quantity and quality. Euphytica, 1997, 96(1): 65-75. [14] T. Nakamura, P. Vrinten, K. Hayakawa, et al. Characterization of a granule-bound starch synthase isoform found in the pericarp of wheat. Plant Physiology, 1998, 118(2): 451-459. [15] J. H. M. Hovenkamp-Hermelink, E. Jacobsen, A. S. Ponstein, et al. Isolation of an amylose-free starch mutant of the potato (So- lanum tuberosum L.). Theoretical and Applied Genetics, 1987, 75(1): 217-221. [16] O. E. Nelson, H. W. Rines. The enzymatic deficiency in the waxy mutant of maize. Biochemical and Biophysical Research Communications, 1962, 9: 297-300. [17] P. Vrinten, T. Nakamura and M. Yamamori. Molecular charac- terization of waxy mutations in wheat. Molecular and General Genetics 1999, 261(3): 463-471. [18] H. Tatge, J. Marshall, C. Martin, et al. Evidence that amylose synthesis occurs within the matrix of the starch granule in potato tubers. Plant, Cell & Environment, 1999, 22(5): 543-550. [19] J. P. Ral, C. Colleoni, F. Wattebled, et al. Circadian clock regula- tion of starch metabolism establishes GBSSI as a major contri- butor to amylopectin synthesis in Chlamydomonas reinhardtii. Plant Physiology, 2006, 142: 305-317. [20] D. C. Fulton, A. Edwards, E. Pilling, et al. Role of granule- bound starch synthase in determination of amylopectin structure and starch granule morphology in potato. Journal of Biological Chemistry, 2002, 277(13): 10834-10841. [21] I. Hanashiro, K. Itoh, Y. Kuratomi, et al. Granule-bound starch synthase I is responsible for biosynthesis of extra-long unit chains of amylopectin in rice. Plant and Cell Physiology, 2008, 49(6): 925-933. [22] K. Denyer, B. Clarke, C. Hylton, et al. The elongation of amy- lose and amylopectin chains in isolated starch granules. The Plant Journal, 1996, 10(6): 1135-1143. [23] S. C. Zeeman, S. M. Smith and A. M. Smith. The priming of amylose synthesis in Arabidopsis leaves. Plant Physiology, 2002, 128(3): 1069-1076. [24] K. Denyer, D. Waite, A. Edwards, et al. Interaction with amy- lopectin influences the ability of granule-bound starch synthase I to elongate malto-oligosaccharides. Biochemical Journal, 1999, 342(3): 647-653. [25] M. Van de Wal, C. D’Hulst, J.P. Vincken, et al. Amylose is syn- thesized in vitro by extension of and cleavage from amylopectin. Journal of Biological Chemistry, 1998, 273(35): 22232-22240. [26] A. Kuipers, E. Jacobsen and R. Visser. Formation and deposition of amylose in the potato tuber starch granule are affected by the reduction of granule-bound starch synthase gene expression. Plant Cell, 1994, 6(1): 43-52. [27] M. Seguchi, M. Hayashi, Y. Suzuki, et al. Role of amylose in the maintenance of the configuration of rice starch granules. Starch- Stärke, 2003, 55(11): 524-528. [28] S. S. Zhao, D. Dufour, T. Sánchez, et al. Development of waxy cassava with different biological and physico-chemical charac- teristics of starches for industrial applications. Biotechnology and Bioengineering, 2011, 108(8): 1925-1935. [29] S. C. Zeeman, J. Kossmann and A. M. Smith. Starch: Its meta- bolism, evolution, and biotechnological modification in plants. Annual Review of Plant Biology, 2010, 61(1): 209-234. [30] J. Kossmann, G. J. W. Abel, F. Springer, et al. Cloning and func- tional analysis of a cDNA encoding a starch synthase from potato (Solanum tuberosum L.) that is predominantly expressed in leaf tissue. Planta, 1999, 208(4): 503-511. [31] Y. Takahata, M. Tanaka, M. Otani, et al. Inhibition of the expres- sion of the starch synthase II gene leads to lower pasting tem- perature in sweetpotato starch. Plant Cell Reports, 2010, 29(6): 535-543. [32] A. Edwards, D. C. Fulton, C. M. Hylton, et al. A combined re- duction in activity of starch synthases II and III of potato has novel effects on the starch of tubers. The Plant Journal, 1999, 17(3): 251-261. [33] J. Marshall, C. Sidebottom, M. Debet, et al. Identification of the major starch synthase in the soluble fraction of potato tubers. Plant Cell, 1996, 8(7): 1121-1135. [34] M. Gao, J. Wanat, P. S. Stinard, et al. Characterization of dull1, a maize gene coding for a novel starch synthase. Plant Cell, 1998, 10(3): 399-412. [35] Y. J. Wang, P. White, L. Pollak, et al. Characterization of starch structures of 17 maize endosperm mutant genotypes with 0h43 inbred line background. Cereal Chemistry, 1993, 70(2): 171-179. [36] I. Roldán, F. Wattebled, M. M. Lucas, et al. The phenotype of soluble starch synthase IV defective mutants of Arabidopsis thaliana suggests a novel function of elongation enzymes in the control of starch granule formation. The Plant Journal, 2007, 49(3): 492-504. [37] N. Szydlowski, P. Ragel, S. Raynaud, et al. Starch granule ini- tiation in Arabidopsis requires the presence of either class IV or class III starch synthases. Plant Cell, 2009, 21(8): 2443-2457. [38] F. Grimaud, H. Rogniaux, M. G. James, et al. Proteome and pho- sphoproteome analysis of starch granule-associated proteins from normal maize and mutants affected in starch biosynthesis. Journal of Experimental Botany, 2008, 59(12): 3395-3406. [39] H. Cao, J. Imparl-Radosevich, H. Guan, et al. Identification of the soluble starch synthase activities of maize endosperm. Plant Physiology, 1999, 120(1): 205-216. [40] T. H. Nielsen, L. Baunsgaard and A. Blennow. Intermediary glu- can structures formed during starch granule biosynthesis are enriched in short side chains, a dynamic pulse labeling approach. Journal of Biological Chemistry, 2002, 277(23): 20249-20255. [41] S. A. Jobling, G. P. Schwall, R. J. Westcott, et al. A minor form of starch branching enzyme in potato (Solanum tuberosum L.) tubers has a major effect on starch structure: Cloning and char- acterisation of multiple forms of SBE A. The Plant Journal, 1999, 18(2): 163-171. [42] T. Shimada, M. Otani, T. Hamada, et al. Increase of amylose content of sweet potato starch by RNA interference of the starch branching enzyme II gene (IbSBEII). Plant Biotechnology, 2006, 23: 85-90. [43] R. Safford, S. A. Jobling, C. M. Sidebottom, et al. Consequences of antisense RNA inhibition of starch branching enzyme activity on properties of potato starch. Carbohydrate Polymers, 1998, 35(3-4): 155-168. [44] G. P. Schwall, R. Safford, R. J. Westcott, et al. Production of very-high-amylose potato starch by inhibition of SBE A and B. Nature Biotechnology, 2000, 18(5): 551-554. [45] U. Rydberg, L. Andersson, R. Andersson, et al. Comparison of starch branching enzyme I and II from potato. European Journal of Biochemistry, 2001, 268(23): 6140-6145. [46] A. Blennow, A. M. Bay-Smidt, B. Wischmann, et al. The degree of starch phosphorylation is related to the chain length distri- bution of the neutral and the phosphorylated chains of amylo- pectin. Carbohydrate Research, 1998, 307(1-2): 45-54. [47] M. K. Morell, A. Blennow, B. Kosar-Hashemi, et al. Differential expression and properties of starch branching enzyme isoforms in developing wheat endosperm. Plant Physiology, 1997, 113(1): 201-208. [48] L. J. C. B. Carvalho, C. R. B. de souza, J. C. De cascardo, et al. Identification and characterization of a novel cassava (Manihot esculenta Crantz) clone with high free sugar content and novel Copyright © 2013 Hanspub 32  薯类植物中的淀粉生物合成及关键酶 Copyright © 2013 Hanspub 33 starch. Plant Molecular Biology, 2004, 56(4): 643-659. [49] H. Hussain, A. Mant, R. Seale, et al. Three isoforms of isoa- mylase contribute different catalytic properties for the debranch- ing of potato glucans. Plant Cell, 2003, 15(1): 133-149. [50] Y. Utsumi, Y. Nakamura. Structural and enzymatic character- ization of the isoamylase1 homo-oligomer and the isoamylase1- isoamylase2 hetero-oligomer from rice endosperm. Planta, 2006, 225(1): 75-87. [51] T. Delatte, M. Trevisan, M. L. Parker, et al. Arabidopsis mutants Atisa1 and Atisa2 have identical phenotypes and lack the same multimeric isoamylase, which influences the branch point distri- bution of amylopectin during starch synthesis. The Plant Journal, 2005, 41(6): 815-830. [52] R. Bustos, B. Fahy, C. M. Hylton, et al. Starch granule initiation is controlled by a heteromultimeric isoamylase in potato tubers. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2215-2220. [53] R. A. Burton, H. Jenner, L. Carrangis, et al. Starch granule initi- ation and growth are altered in barley mutants that lack isoa- mylase activity. The Plant Journal, 2002, 31(1): 97-112. [54] D. Dauvillée, C. Colleoni, G. Mouille, et al. Biochemical charac- terization of wild-type and mutant isoamylases of chlamydo- monas reinhardtii supports a function of the multimeric enzyme organization in amylopectin maturation. Plant Physiology, 2001, 125(4): 1723-1731. [55] Y. Nakamura. Towards a better understanding of the metabolic system for amylopectin biosynthesis in plants: rice endosperm as a model tissue. Plant and Cell Physiology, 2002, 43(7): 718-725. [56] A. M. Myers, M. K. Morell, M. G. James, et al. Recent progress toward understanding biosynthesis of the amylopectin crystal. Plant Physiology, 2000, 122(4): 989-998. [57] S. Streb, T. Delatte, M. Umhang, et al. Starch granule biosyn- thesis in arabidopsis is abolished by removal of all debranching enzymes but restored by the subsequent removal of an endoa- mylase. Plant Cell, 2008, 20(12): 3448-3466. [58] D. Beyene, Y. Baguma, S. B. Mukasa, et al. Characterisation and role of Isoamylase1 (Meisa1) gene in cassava. African Crop Sci- ence Journal, 2010, 18: 1-8. [59] S. H. Kim, T. Hamada, M. Otani, et al. Cloning and character- ization of sweetpotato isoamylase gene (IbIsa1) isolated from tuberous root. Breeding Science, 2005, 55(4): 453-458. [60] U. Sonnewald, A. Basner, B. Greve, et al. A second L-type iso- zyme of potato glucan phosphorylase: Cloning, antisense inhi- bition and expression analysis. Plant Molecular Biology, 1995, 27(3): 567-576. [61] H. Satoh, K. Shibahara, T. Tokunaga, et al. Mutation of the plastidial α-glucan phosphorylase gene in rice affects the syn- thesis and structure of starch in the endosperm. Plant Cell, 2008, 20(7): 1833-1849. [62] I. J. Tetlow, R. Wait, Z. Lu, et al. Protein phosphorylation in amyloplasts regulates starch branching enzyme activity and protein-protein interactions. Plant Cell 2004, 16(3): 694-708. [63] T. Albrecht, A. Koch, A. Lode, et al. Plastidic (Pho1-type) pho- sphorylase isoforms in potato (Solanum tuberosum L.) plants: Expression analysis and immunochemical characterization. Planta, 2001, 213(4): 602-613. [64] S. G. Ball and M. K. Morell. From bacterial glycogen to starch: Understanding the biogenesis of the plant starch granule. Annual Review of Plant Biology, 2003, 54(1): 207-233. [65] T. Takaha, J. Critchley, S. Okada, et al. Normal starch content and composition in tubers of antisense potato plants lacking D- enzyme (4-α-glucanotransferase). Planta, 1998, 205(3): 445-451. [66] M. Steup, H. Robenek and M. Melkonian. In-vitro degradation of starch granules isolated from spinach chloroplasts. Planta, 1983, 158(5): 428-436. [67] E. Duwenig, M. Steup, L. Willmitzer, et al. Antisense inhibition of cytosolic phosphorylase in potato plants (Solanum tuberosum L.) affects tuber sprouting and flower formation with only little impact on carbohydrate metabolism. The Plant Journal, 1997, 12(2): 323-333. [68] J. P. Davis, N. Supatcharee, R. L. Khandelwal, et al. Synthesis of novel starches in planta: Opportunities and challenges. Starch- Stärke, 2003, 55(3-4): 107-120. [69] A. Stensballe, S. Hald, G. Bauw, et al. The amyloplast proteome of potato tuber. FEBS Journal, 2008, 275(8): 1723-1741. [70] I. J. Tetlow, K. G. Beisel, S. Cameron, et al. Analysis of protein complexes in wheat amyloplasts reveals functional interactions among starch biosynthetic enzymes. Plant Physiology, 2008, 146(4): 1878-1891. [71] T. A. Hennen-Bierwagen, Q. Lin, F. Grimaud, et al. Proteins from multiple metabolic pathways associate with starch biosyn- thetic enzymes in high molecular weight complexes: A model for regulation of carbon allocation in maize amyloplasts. Plant Physiology, 2009, 149(3): 1541-1559. [72] T. A. Hennen-Bierwagen, F. Liu, R. S. Marsh, et al. Starch bio- synthetic enzymes from developing maize endosperm associate in multisubunit complexes. Plant Physiology, 2008, 146(4): 1892-1908. [73] F. Liu, Z. Ahmed, E. A. Lee, et al. Tetlow allelic variants of the amylose extender mutation of maize demonstrate phenotypic variation in starch structure resulting from modified protein: Protein interactions Journal of Experimental Botany, 2012, 63(3): 1167-1183. [74] K. Raemakers, M. Schreuder, L. Suurs, et al. Improved cassava starch by antisense inhibition of granule-bound starch synthase I. Molecular Breeding, 2005, 16(2): 163-172. |