 Material Sciences 材料科学, 2013, 3, 56-60 http://dx.doi.org/10.12677/ms.2013.32011 Published Online March 2013 (http://www.hanspub.org/journal/ms.html) Preparation and Lysozyme Adsorption Performance of Mesostructured Cellular Foams with Different Pore Size* Jun Li, Guangfu Yin#, Y i Ding College of Materials Science and Engineering, Sichuan University, Chengdu Email: #nic0700@scu.edu.cn Received: Jan. 14th, 2013; revised: Feb. 1st, 2013; accepted: Feb. 16th, 2013 Abstract: The mesostructured cellular foams (MCFs) were synthesized using microemulsion templating, in which the nonionic triblock copolymer surfactant Pluronic P123 was served as template and 1,3,5-trimethylbenzene (TMB) as organic swelling agent. By controlling the mass ratio of TMB/P123, a series of MCFs with different pore size were prepared, and then the structural and chemical properties of MCFs were characterized by TEM and nitrogen adsorption. It was found that the pore size of MCFs increased when the mass ratio of TMB/P123 increased from 0.5 to 1.0, while that of MCFs decreased when the mass ratio continuously increased to 1.5. The MCFs were used as adsorbent for the adsorption of lysozyme. The maximum adsorption rate was obtained on MCFs-1.5 (mass ratio of TMB/P123 was 1.5), meaning that the sample reached equilibrium within 1 h. The immobilization of lysozyme on MCFs-1.5 prevented the leaching of enzyme effectively and the immobilized amount was up to 490 mg/g. Furthermore, FT-IR analysis revealed that the lysozyme adsorbed on MCFs could be held without evident structure changes. This study suggested that en- zyme loading efficiency was clearly dependent on the size matching between the enzyme molecules and carrier pores, and the synthesized MCFs could be applied as excellent carriers for enzyme immobilization. Keywords: MCFs; Lysozyme; Carrier; Immobilized Amount; Adsorption Rate 不同孔径 MCFs 的制备及其对 溶菌酶的吸附性能* 李 俊,尹光福#,丁 艺 四川大学材料科学与工程学院,成都 Email: #nic0700@scu.edu.cn 收稿日期:2013 年1月14 日;修回日期:2013年2月1日;录用日期:2013 年2月16 日 摘 要:以三嵌段共聚物聚氧乙烯–聚氧丙烯–聚氧乙烯(Pluronic P123)及三甲苯(TMB)为模板剂及扩孔剂,采 用微乳液模板法,通过控制 TMB 与P123 的质量比合成了一系列不同孔径的介孔泡沫分子筛(MCFs),利用 TEM、 N2吸附等手段对材料进行结构及性能表征。当 TMB/P123 质量比由 0.5 增至 1.0 时,材料的孔径增大,当其继 续增至 1.5 时,孔径变小;溶菌酶吸附性能测试发现,质量比为 1.5 时合成的 MCFs,其吸附速率最快,约 1 h 达到平衡,且其对酶的固定最牢固,酶不易脱落,吸附量可达到 490 mg/g;此外,FT-IR 分析发现MCFs 吸附 对溶菌酶的结构无明显影响。研究结果表明,MCFs合成时的 TMB/P123质量比通过影响 MCFs 孔结构从而对 酶吸附性能产生重要的影响;MCFs 有望成为优良的酶载体材料。 关键词:MCFs;溶菌酶;载体;载酶量;吸附速率 *资助信息:国家自然科学基金(51173120)。 #通讯作者。 Copyright © 2013 Hanspub 56  不同孔径 MCFs 的制备及其对溶菌酶的吸附性能 Copyright © 2013 Hanspub 57 1. 引言 自1992 年Mobil 公司首次报道了 M41S 系列介孔 材料以来[1,2],其就因较大的比表面积及孔容,有序的 孔道结构,可调的孔径,优良的化学、水热稳定性及 生物相容性等优点,成为酶固定载体领域的研究热点 [3,4]。近年来,一种新型的介孔泡沫材料(Mesostructured Cellular Foams, MCFs)[5,6]因其特殊的结构引起了人们 的广泛关注。它是一种具有3D 介孔结构和超大孔径 的介孔氧化硅,这种结构是一种新奇的蜂窝状介孔泡 沫结构,其球形孔室由均一的窗口连通成为三维孔 道,孔容为 1.0~2.4 cm3/g,孔径为 16~42 nm,是目前 孔径最大的介孔材料。由于 MCFs 具有较大直径的球 形孔室和均一的窗口,对酶、底物以及产物分子的扩 散具有优异的传输性能[7,8],因此,其有望成为性能更 加优异的酶固定载体。 一般说来,最常见的固定酶的方法包括化学共价 结合及物理吸附法。与化学共价键法相比,物理吸附 法操作简单,回收率高,固定过程中酶不参加化学反 应,整体结构保持不变,故其催化活性得到很好的保 留。但其最大的缺点是酶与载体间的相互作用较弱, 酶易脱落。有研究指出,对载体材料孔径的调控可以 很好的解决上述问题[9,10]。目前以MCFs 为载体的物 理法载酶的研究较少,尤其关于其孔径及窗口直径对 固定化酶性能的影响尚未见文献报道。同时,由于溶 菌酶(Lysozyme, LYZ)的分子尺寸较小(3.0 nm × 3.0 nm × 4.5 nm),且结构简单,故其多应用于固定化酶 的研究中[11]。因此,本文通过控制扩 孔剂(1,3,5- 三甲 苯)与模板剂(Pluronic P123)的质量比,合成了不同孔 径的 MCFs,借助TEM 及氮气吸附–脱附等手段对其 进行了初步表征。并在pH = 9.6的Na2CO3-NaHCO3 缓冲溶液中研究了 MCFs 的孔径及窗口直径对溶菌酶 吸附性能的影响,表征了吸附量及吸附速率,并分析 了原因,利用红外光谱分析了吸附前后溶菌酶的结构 变化。 2. 实验 2.1. 原料与试剂 三嵌段共聚物聚氧乙烯–聚氧丙烯–聚氧乙烯 (Pluronic P123, EO20PO70EO20, Mav = 5800),溶菌酶(EC 3.2.1.17) 购自美国 Sigma 公司。正硅酸乙酯(Tetraeth- oxysilane, TEOS),1,3,5-三甲苯(Trimethylbenzene, TMB) 购自成都市科龙化工试剂厂。所有试剂均为分析纯, 溶液的配制均使用二次水。 2.2. MCFs的制备 采用微乳液模板法[5,6]制备 MCFs,具体过程如下: 在40℃下,将2.0 g Pluronic P123 溶于 60 ml 2.3 M 的 盐酸溶液中;待 P123 完全溶解后,为了制备不同孔 径的 MCFs,分别缓慢滴入1.0 g,2.0 g及3.0 g TMB, 剧烈搅拌1 h 后,加入 4.4 g TEOS,剧烈搅拌约 2 min, 然后将其于 40℃下静置 20 h。紧接着将溶液转入水热 晶化反应釜中,并置于100℃的烘箱中处理24 h。待 溶液冷却至室温后,洗涤过滤得到白色固体,室温真 空干燥。模板剂的去除采用高温煅烧的方法,将白色 固体在马弗炉中程序升温至550℃,保温 6 h后,自 然冷却至室温,得到的白色粉末即为 MCFs。将样品 标记为 MCFs-X,其中 X表示 TMB 与P123的质量比。 2.3. 溶菌酶的吸附 根据 Bhattacharyya 等人的研究[11],当 吸附pH 接 近溶菌酶等电点(PI ≈ 11)时,其可达到最大吸附量。 然而当 pH 为11时,MCFs的硅表面易溶于溶液,因 此,我们选择pH = 9.6的Na2CO3-NaHCO3缓冲液作 为吸附实验的缓冲体系。具体操作过程如下:首先称 取溶菌酶 8.0 mg溶于 4 ml Na2CO3-NaHCO3缓冲液 (0.1M,pH = 9.6),得到 2.0 mg/ml 的原酶溶液。然后 分别称取上述三种样品各 8.0 mg 于10 ml 离心管中, 加入 4 ml 缓冲溶液超声 10 min。最后取原酶溶液 4 ml 加入上述混合液中,则最终溶菌酶的初始浓度为 1.0 mg/ ml ,溶液体积为 8 ml。将上述混合体系室温下振 荡。在选定的时间点将混合物离心(12000 rpm, 5 min), 测量上清液在 280 nm处的吸光度,并由此计算溶菌 酶浓度。为了去除表面吸附的溶菌酶,当吸附达平衡 后,将样品用同样的Na2CO3-NaHCO3缓冲液清洗 3 次,室温下真空干燥,并将最终得到的固体储存于 4 ℃冰箱中以备红外光谱检测。酶的吸附量按下式(1) 计算: LYZ0 0 LVCCM (1) 其中,LLYZ (mg/g)表示吸附量,V0 (ml)表示溶液初始 体积,C0 (mg/ml)表示溶菌酶的初始浓度,C (mg/ml) 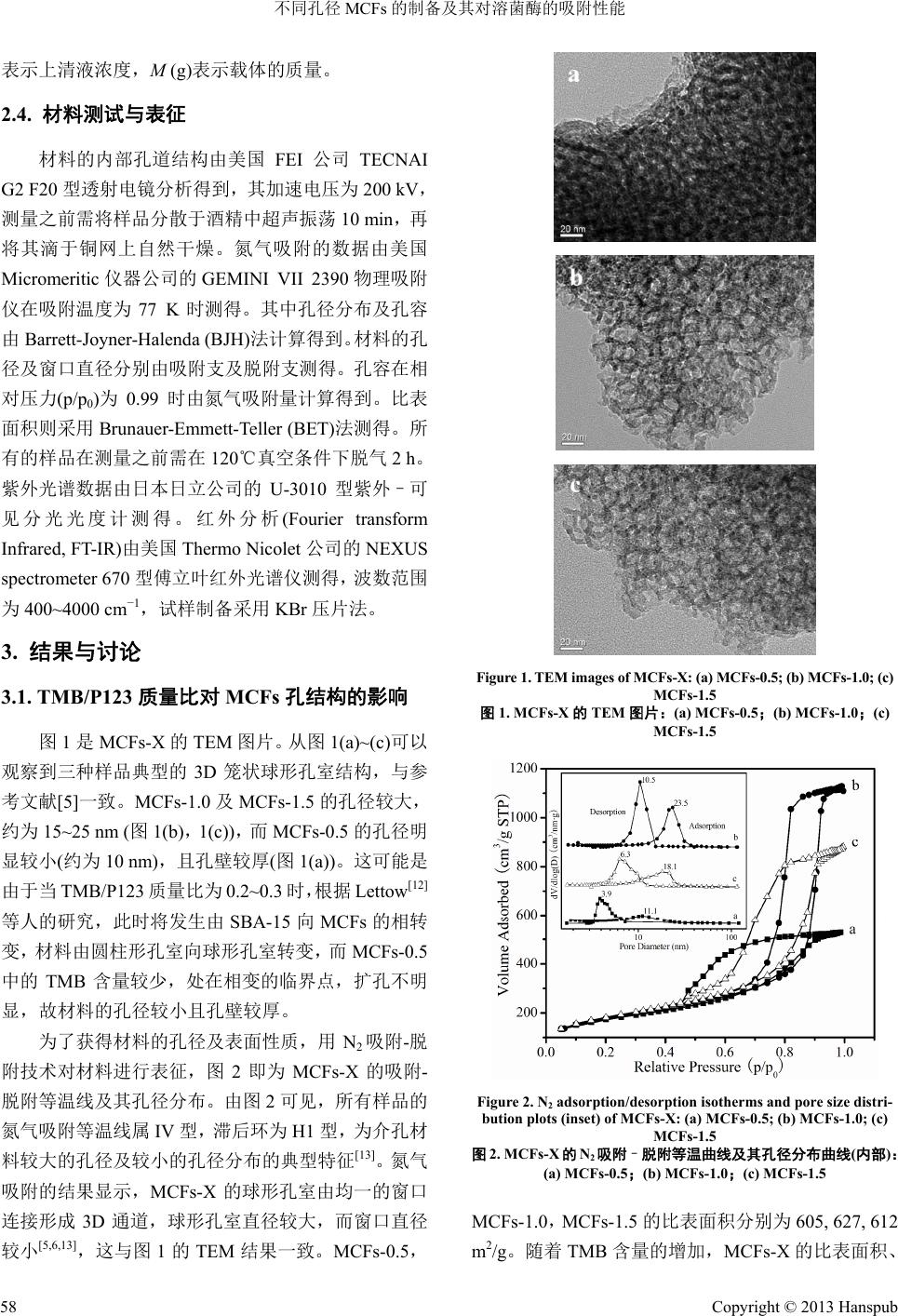 不同孔径 MCFs 的制备及其对溶菌酶的吸附性能 表示上清液浓度,M (g)表示载体的质量。 2.4. 材料测试与表征 材料的内部孔道结构由美国FEI 公司TECNAI G2 F20 型透射电镜分析得到,其加速电压为 200 kV, 测量之前需将样品分散于酒精中超声振荡10 min,再 将其滴于铜网上自然干燥。氮气吸附的数据由美国 Micromeritic仪器公司的 GEMINI VII 2390物理吸附 仪在吸附温度为77 K时测得。其中孔径分布及孔容 由Barrett-Joyner-Halenda (BJH)法计算得到。材料的孔 径及窗口直径分别由吸附支及脱附支测得。孔容在相 对压力(p/p0)为0.99 时由氮气吸附量计算得到。比表 面积则采用Brunauer-Emmett-Teller (BET)法测得。所 有的样品在测量之前需在 120℃真空条件下脱气 2 h。 紫外光谱数据由日本日立公司的U-3010 型紫外–可 见分光光度计测得。红外分析(Fourier transform Infrared, FT-IR)由美国Thermo Nicolet 公司的 NEXUS spectrometer 670 型傅立叶红外光谱仪测得,波数范围 为400~4000 cm−1,试样制备采用 KBr 压片法。 3. 结果与讨论 3.1. TMB/P123质量比对 MCFs 孔结构的影响 图1是MCFs-X 的TEM 图片。从图 1(a)~(c)可以 观察到三种样品典型的3D 笼状球形孔室结构,与参 考文献[5]一致。MCFs-1.0及MCFs-1.5的孔径较大, 约为 15~25 nm (图1(b),1(c)),而 MCFs-0.5 的孔径明 显较小(约为 10 nm),且孔壁较厚(图1(a))。这可能是 由于当 TMB/P123 质量比为 0.2~0.3 时,根据 Lettow[12] 等人的研究,此时将发生由SBA-15向MCFs 的相转 变,材料由圆柱形孔室向球形孔室转变,而 MCFs-0.5 中的 TMB 含量较少,处在相变的临界点,扩孔不明 显,故材料的孔径较小且孔壁较厚。 为了获得材料的孔径及表面性质,用N2吸附-脱 附技术对材料进行表征,图2即为MCFs-X 的吸附- 脱附等温线及其孔径分布。由图 2可见,所有样品的 氮气吸附等温线属 IV 型,滞后环为H1 型,为介孔材 料较大的孔径及较小的孔径分布的典型特征[13]。氮 气 吸附的结果显示,MCFs-X 的球形孔室由均一的窗口 连接形成 3D通道,球形孔室直径较大,而窗口直径 较小[5,6,13],这与图 1的TEM 结果一致。MCFs-0.5, Figure 1. TEM images of MCFs-X : (a) MCFs- 0.5; ( b) MCFs-1. 0; (c) MCFs-1.5 图1. MCFs-X的TEM 图片:(a) MCFs-0.5;(b) MCFs-1.0;(c) MCFs-1.5 Figure 2. N2 adsorption/desorption isotherms and pore siz e d is tri- bution plots (inset) of MCFs-X: (a) MCFs-0.5; (b) MCFs-1.0; (c) MCFs-1.5 图2. MCFs-X的N2吸附–脱附等温曲线及其孔径分布曲线(内部): (a) MCFs-0.5;(b) MCFs-1.0;(c) MCFs-1.5 MCFs-1.0,MCFs-1.5 的比表面积分别为605, 627, 612 m2/g。随着 TMB含量的增加,MCFs-X 的比表面积、 Copyright © 2013 Hanspub 58 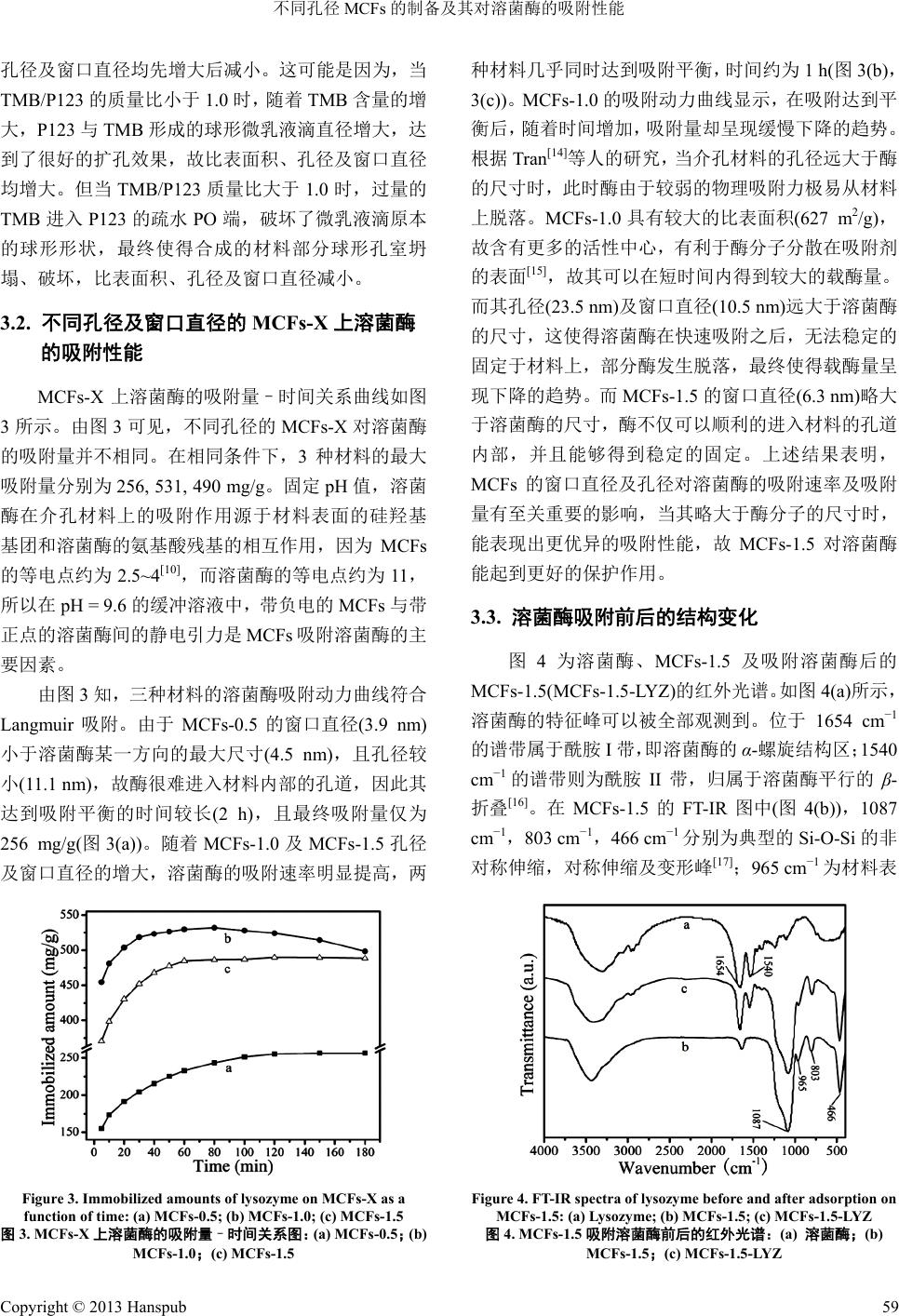 不同孔径 MCFs 的制备及其对溶菌酶的吸附性能 孔径及窗口直径均先增大后减小。这可能是因为,当 TMB/P123 的质量比小于 1.0时,随着 TMB含量的增 大,P123与TMB 形成的球形微乳液滴直径增大,达 到了很好的扩孔效果,故比表面积、孔径及窗口直径 均增大。但当 TMB/P123 质量比大于 1.0 时,过量的 TMB 进入 P123 的疏水 PO 端,破坏了微乳液滴原本 的球形形状,最终使得合成的材料部分球形孔室坍 塌、破坏,比表面积、孔径及窗口直径减小。 菌酶3.2. 不同孔径及窗口直径的 MCFs-X 上溶 MCFs-X 上溶 附量–时间关系曲线如图 3所 知,三种材料的溶菌酶吸附动力曲线符合 Lang 的吸附性能 菌酶的吸 示。由图 3可见,不同孔径的 MCFs-X 对溶菌酶 的吸附量并不相同。在相同条件下,3种材料的最大 吸附量分别为256, 531, 490 mg/g。固定 pH 值,溶菌 酶在介孔材料上的吸附作用源于材料表面的硅羟基 基团和溶菌酶的氨基酸残基的相互作用,因为 MCFs 的等电点约为 2.5~4[10],而溶菌酶的等电点约为11, 所以在 pH = 9.6 的缓冲溶液中,带负电的 MCFs 与带 正点的溶菌酶间的静电引力是 MCFs吸附溶菌酶的主 要因素。 由图 3 muir 吸附。由于 MCFs-0.5的窗口直径(3.9 nm) 小于溶菌酶某一方向的最大尺寸(4.5 nm),且孔径较 小(11.1 nm),故酶很难进入材料内部的孔道,因此其 达到吸附平衡的时间较长(2 h),且最终吸附量仅为 256 mg/g(图3(a))。随着 MCFs-1.0 及MCFs-1.5 孔径 及窗口直径的增大,溶菌酶的吸附速率明显提高,两 Figure 3. Immobilized amounts of lysozyme on MCFs-X as a 图 [15] 构变化 附溶菌酶后的 MCFs-1 −1 16] −1− function of time: (a) MCFs-0.5; (b) MCFs-1.0; (c) MCFs-1.5 3. MCFs-X上溶菌酶的吸附量–时间关系图:(a) MCFs-0.5;(b) MCFs-1.0;(c) MCFs-1.5 种材料几乎同时达到吸附平衡,时间约为 1 h(图3(b), 3(c))。MCFs-1.0 的吸附动力曲线显示,在吸附达到平 衡后,随着时间增加,吸附量却呈现缓慢下降的趋势。 根据 Tran[14]等人的研究,当介孔材料的孔径远大于酶 的尺寸时,此时酶由于较弱的物理吸附力极易从材料 上脱落。MCFs-1.0 具有较大的比表面积(627 m2/g), 故含有更多的活性中心,有利于酶分子分散在吸附剂 的表面 ,故其可以在短时间内得到较大的载酶量。 而其孔径(23.5 nm)及窗口直径(10.5 nm)远大于溶菌酶 的尺寸,这使得溶菌酶在快速吸附之后,无法稳定的 固定于材料上,部分酶发生脱落,最终使得载酶量呈 现下降的趋势。而MCFs-1.5 的窗口直径(6.3 nm)略大 于溶菌酶的尺寸,酶不仅可以顺利的进入材料的孔道 内部,并且能够得到稳定的固定。上述结果表明, MCFs 的窗口直径及孔径对溶菌酶的吸附速率及吸附 量有至关重要的影响,当其略大于酶分子的尺寸时, 能表现出更优异的吸附性能,故MCFs-1.5 对溶菌酶 能起到更好的保护作用。 3.3. 溶菌酶吸附前后的结 图4为溶菌酶、MCFs-1.5 及吸 .5(MCFs-1.5-LYZ)的红外光谱。如图4(a)所示, 溶菌酶的特征峰可以被全部观测到。位于 1654 cm−1 的谱带属于酰胺 I带,即溶菌酶的α-螺旋结构区;1540 cm 的谱带则为酰胺 II带,归属于溶菌酶平行的β- 折叠[。在 MCFs-1.5 的FT-IR 图中(图4(b)),1087 cm ,803 cm−1,466 cm1分别为典型的Si-O-Si 的非 对称伸缩,对称伸缩及变形峰[17];965 cm−1为材料表 Figure 4. FT-IR spectra of lysozyme before and after adsoron on MCFs-1.5: (a) Lysozyme; (b) MCFs-1.5; (c) MCFs-1.5-LZ pti Y 图4. MCFs-1.5吸附溶菌酶前后的红外光谱:(a) 溶菌酶;(b) MCFs-1.5;(c) MCFs-1.5-LYZ Copyright © 2013 Hanspub 59  不同孔径 MCFs 的制备及其对溶菌酶的吸附性能 Copyright © 2013 Hanspub 60 面 乳液模板法,通过控制 TMB 与P123的质 量比 参考文献 (References) z, W. J. Roth, et al. Ordered ynthesized by a liquid-crystal w family of . V. Jasra, B. L. Newalkar, et al. Studies on the anpranot, C. Thanachayanant, et al. Effects of ns, D. Zhao, et al. Mesocellular mulsion ska, J. Bryjak, J. Mrowiec-Białoń, et al. Application sensor based on e l. Lysozyme al to ea and pososity. ive of recent progress in im- 钛的合 hou, C. Li, et al. Adsorption and catalytic activity of 的Si-OH 特征峰[11]。由图 4(c)知,MCFs-1.5-LYZ 既含有溶菌酶的特征峰,又含有MCFs-1.5 的特征峰, 且位置及强度未发生明显的变化,说明整个吸附过程 不会影响溶菌酶分子的结构,MCFs-1.5 是有较大潜力 的蛋白质运输载体。 4. 结论 采用微 ,合成了不同孔径的 MCFs。TEM结果显示了 MCFs 典型的 3D 笼状球形孔室。利用氮气吸附等温 线分析了材料的介孔结构及比表面积。当 TMB/P123 的质量比小于1.0 时,随着 TMB 浓度的增大,材料的 比表面积、孔径及窗口直径均增大,而当 TMB/P123 质量比大于 1.0时,随着 TMB 浓度的增大,过量的 TMB 反而破坏了微乳液滴的球形形状,导致部分球形 孔室坍塌、破坏,材料的比表面积、孔径及窗口直径 减小。对合成的材料进行溶菌酶吸附性能测试,发现 材料的窗口直径及孔径过小或过大,将导致酶不易进 入材料内部孔道或更易从其上脱落。MCFs-1.5的窗口 直径及孔径略大于溶菌酶的分子尺寸,使得其作为载 体表现出更优良的固定性能:其吸附速率较快,约1 h 达到平衡,且载酶量可达 490 mg/g。通过 FT-IR 分析, MCFs-1.5 不会影响溶菌酶的结构。由此,作为酶载体, MCFs 的孔径及窗口直径对其载酶性能有着关键性的 影响。孔径与酶分子尺寸更为匹配的MCFs 将会成为 性能更加优异的载体,从而广泛应用于催化、吸附、 生物传感器、酶燃料电池等领域。 [1] C. T. Kresge, M. E. Leonowic mesoporous molecular sieves s template mechanism. Nature, 1992, 359: 710-712. [2] J. S. Beck, J. C. Vartuli, W. J. Roth, et al. A ne mesoporous molecular sieves prepared with liquid crystal tem- plates. Journal of the American Chemical Society, 1992, 114(27): 10834-10843. [3] P. H. Pandya, R activity and stability of immobilized α-amylase in ordered mesoporous silicas. Microporous and Mesoporous Materials, 2005, 77: 67-77. [4] W. Chouyyok, J. P pH and pore characters of mesoporous silicas on horseradish peroxidase immobilization. Journal of Molecular Catalysis B: Enzymatic, 2009, 56: 246-252. [5] P. Schmidt-Winkel, W. W. Luke siliceous foams with uniformly sized cells and windows. Journal of the American Chemical Society, 1999, 121: 254-255. [6] P. Schmidt-Winkel, W. W. Lukens, P. Yang, et al. Microe templating of siliceous mesostructured cellular foams with well- defined ultralarge mesopores. Chemistry of Materials, 2000, 12: 686-696. [7] K. Szymań and properties of siliceous mesostructured cellular foams as enzymes carriers to obtain efficient biocatalysts. Microporous and Mesoporous Materials, 2007, 99: 167-175. [8] S. Wu, L. Zhang, L. Qi, et al. Ultra-sensitive bio mesocellular silica foam for organophosphorous pesticide detection. Biosensors and Bioelectronics, 2011, 26: 2864-2869. [9] A. Katiyar, L. Ji, P. Smirniotis, et al. Protein adsorption on the mesoporous molecular sieve silicate SBA-15: Effects of pH and pore size. Journal of Chromatography A, 2005, 1069: 119-126. [10] S. Hudson, E. Magner, J. Cooney, et al. Methodology for th immobilization of enzymes onto mesoporous materials. Journal of Physical Chemistry B, 2005, 109: 19496-19506. [11] M. S. Bhattacharyya, P. Hiwale, M. Piras, et a adsorption and release from ordered mesoporous materials. Journal of Physical Chemistry C, 2010, 114: 19928-19934. [12] J. S. Lettow, Y. J. Han, P. Schmidt-Winkel, et al. Hexagon mesocellular foam phase transition in polymer-templated meso- porous silicas. Langmuir, 2000, 16: 8291-8295. [13] S. J. Gregg, K. S. W. Sing. Adsorption, surface ar New York: Academic Press, 1982. [14] D. T. Tran, K. J. Balkus. Perspect mobilization of enzymes. Catalysis, 2011, 1: 956-968. [15] 李霞, 邢向英, 任铁真. 具有大孔–介孔结构的磷酸 成及溶菌酶吸附[J]. 河北工业大学学报, 2012, 41(1): 38-43. [16] 代文彦, 邹永存, 王海果等. 孔径和比表面积调控对 SBA-15 上溶菌酶吸附动力学的影响[J]. 吉林大学 学报, 2011, 49(1): 139-144. [17] Y. Li, G. Z porcine pancreatic lipase on rod-like SBA-15 mesoporous material. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2009, 34: 79-85. |